Подтвердите, пожалуйста, являетесь ли Вы дипломированным специалистом в сфере здравоохранения?
СОГЛАСНО ДЕЙСТВУЮЩЕМУ ЗАКОНОДАТЕЛЬСТВУ ИНФОРМАЦИЯ, ПРЕДОСТАВЛЕННАЯ В ДАННОМ РАЗДЕЛЕ, ПРЕДНАЗНАЧЕНА ИСКЛЮЧИТЕЛЬНО ДЛЯ ДИПЛОМИРОВАННЫХ СПЕЦИАЛИСТОВ В СФЕРЕ МЕДИЦИНЫ И ФАРМАЦЕВТИКИ
М.В. ПУТИЛИНА, З.Ю. МУТОВИНА, О.В. КУРУШИНА, Д.М. ХАЛИЛОВА, Е.Н. САВЕРСКАЯ, С.Б. СТЕПАНОВА, М.А. ХОРЕВА, А.С. СТАРИКОВ
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
ГБУЗ «Городская клиническая больница №52» Департамента здравоохранения Москвы, Москва, Россия;
ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России, Волгоград, Россия;
Азербайджанский государственный медицинский университет, Баку, Азербайджан;
Медицинский институт непрерывного образования ФГБОУ ВО «Московский государственный университет пищевых производств», Москва, Россия;
ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия;
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России, Барнаул, Россия;
ФГБОУ ВО «Сыктывкарский государственный университет им. Питирима Сорокина», Сыктывкар, Россия
Резюме
Цель исследования. Изучение распространенности и клинических проявлений постковидного синдрома (ПКС) у амбулаторных пациентов и оценка эффективности терапии препаратом Кортексин в дозах 10 и 20 мг в/м в течение 10 дней.
Материал и методы. Обследованы 979 пациентов с ПКС из регионов Российской Федерации, Азербайджана, Киргизии и Казахстана, средний возраст 54,6±4,5 года, давность перенесенного COVID-19 от 1 мес и более. Исследование включало 3 визита. Первый — в день обращения (оценка жалоб, анализ показателей шкал, назначение препарата Кортексин в дозах 10—20 мг в/м в течение 10 дней). Второй (телефонный опрос) — на 10—14-е сутки. Третий — на 30-е сутки амбулаторного лечения. Оценка состояния проводилась по шкале оценки астении, краткой шкале оценки психического статуса, пробе Шульте, шкале субъективной оценки качества лечения.
Результаты. Доля пациентов с ПКС составила до 30% в общей структуре неврологического приема. Наиболее распространенные проявления: утомляемость, общая слабость, снижение памяти и концентрации внимания, головокружение, нарушения сна, раздражительность, агрессия; реже регистрировались: одышка, болевые синдромы, повышенная потливость, аносмия, гипосмия, дисгевзия, парестезии, выпадение волос, ухудшение зрения, тахикардия, аллергические реакции, нарушения менструального цикла, эректильная дисфункция, апатия, панические атаки, суицидиальные мысли, депрессия, отказ от мясной пищи.
Заключение. Не выявлено связи между клинической симптоматикой и тяжестью COVID-19, объемом поражения легочной ткани, разными сроками постковидного синдрома. Доказана эффективность препарата Кортексин в дозировках 10 и 20 мг для коррекции когнитивных и астенических проявлений ПКС. Выявлена противотревожная, антидепрессивная и анксиолитическая активность Кортексина, более выраженная при использовании дозировки 20 мг.
Ключевые слова: SARS-CoV-2, COVID-19, постковидный синдром, распространенность, усталость, когнитивные нарушения, нарушение обоняния, Кортексин.
Постковидный синдром (ПКС) включает последствия коронавирусной инфекции COVID-19, в рамках которой у 20% пациентов до 12 нед и более наблюдается разнообразная симптоматика. В настоящее время отсутствуют единые данные о частоте развития ПКС, так как уровень заболеваемости в различных странах варьирует. Также имеются трудности полного описания его клинических проявлений и возможных стратегий терапии. Существуют различные направления терапии ПКС, часто с этой целью применяются антиоксиданты, однако минимизация повреждающего воздействия активных форм кислорода может быть недостаточной для предотвращения клеточного повреждения, опосредованного вирусом. Необходимо повысить адаптацию нейронов к повреждению, увеличить их жизнеспособность в неблагоприятных условиях. Избыточное количество провоспалительных цитокинов, в частности интерлейкина (ИЛ)-1, приводит к экспрессии мозгового нейротрофического фактора (BDNF), поэтому восстановление нейротрофики связано со степенью снижения выраженности цитокинового шторма, в связи с чем целесообразно использование нейротрофических факторов, таких как BDNF и фактор роста нервов (NGF). BDNF индуцирует экспрессию ядерного фактора транскрипции NF-κB, регулирующего активацию, дифференциацию и эффекторную функцию воспалительных Т-клеток и инфламмасом. Это возможно при активации зависимого от BDNF пути TrkB-передачи сигналов нейротрофинов, ответственных за синаптическую пластичность. Передача сигналов TrkB, в частности путь TrkB/ фосфатидилинозитол-3-киназа/протеинкиназы B, способствует активации и ядерной транслокации Nrf2 и, таким образом, обеспечивает защиту нейрона от прямого и опосредованного повреждения вирусом. Увеличение количества активированных глиальных клеток, концентрации ряда цитокинов в гиппокампе, коре головного мозга, черной субстанции и стриатуме (в частности, фактора некроза опухоли — TNF-α) ассоциировано с уменьшением объема гиппокампа и появлением/прогрессированием когнитивных нарушений. В условиях выраженной вирусной агрессии гематоэнцефалический барьер (ГЭБ) остается препятствием для доставки терапевтических средств, поэтому небольшие эндогенные пептиды, которые, не будучи собственно нейротрофинами, взаимодействуют с соответствующими рецепторами, стимулируют синтез рилизингфакторов в соответствующих регионах мозга и легко проникают через ГЭБ.
Особая роль отводится так называемым SMART-пептидам (англ.: умный), обладающим высокой избирательностью, эффективностью и безопасностью. Применение SMART-пептидов может рассматриваться как ключевая фармакологическая стратегия терапии ПКС благодаря их способности к селективному связыванию, самосборке и адекватной силе биологического ответа. Представителем этого класса препаратов является Кортексин, способный оказывать прямое и опосредованное нейротрофическое воздействие на клетки, стимулируя рост нейритов или предупреждая гибель нейронов, культивируемых в среде, лишенной ростовых факторов. Кортексин обладает системным и локальным противовоспалительным эффектами, достоверно снижая уровни ИЛ-1 и TNF-α, взаимодействуя с креатинкиназой BB, оказывает влияние на энергетический метаболизм, обеспечивая нейропротективный эффект в условиях гипоксии, усиливает внутримозговой обмен серотонина и адреналина, стимулирует восходящую норадренергическую систему, обладает мембраностабилизирующим и антиоксидантным эффектами. Их гиперэкспрессия приводит к снижению адгезии лейкоцитов к эндотелию и их миграции через эндотелий, уменьшению экспрессии провоспалительных цитокинов и повышению плотности гематоэнцефалического барьера (ГЭБ), уменьшая его проницаемость. Белки цитоскелета, взаимодействующие с Кортексином (актин, протеин 14-3-3-α/β), образуют плотные контакты в эндотелии сосудов, способствуя сохранению целостности ГЭБ, что крайне важно в условиях вирусного поражения. Препарат, влияя на ГАМК-рецепторы и ионотропные и метаботропные глутаматные рецепторы, предотвращает эксайтотоксичность, способствует оптимизации процессов возбуждения и торможения, что клинически значимо для пациентов с хронической ишемией головного мозга (ХИМ), цефалгическим и вестибулоатактическим синдромами. Все идентифицированные 4 белка головного мозга, вступающие во взаимодействие с пептидами Кортексина (тубулин β5, креатинкиназа BB, протеин 14-3-3 α/β, актин), обеспечивают созревание и встраивание молодых нейронов в нейрональную сеть, регулируют активность ферментов, защиту от дефосфорилирования белков, процессы секвестрирования, нейропротекцию при нейродегенеративных заболеваниях. Основные механизмы этих процессов базируются на изменении экспрессии генов, регулирующих синтез нейротрофических факторов, BDNF и NGF.
Цель многоцентровой клинико-эпидемиологической наблюдательной программы КОРТЕКС — изучение распространенности, клинических проявлений ПКС у пациентов на амбулаторном неврологическом приеме и оценка эффективности терапии с использованием препарата Кортексин в дозах 10 и 20 мг в/м в течение 10 дней.
В наблюдательной программе КОРТЕКС принимали участие 674 невролога из всех регионов Российской Федерации, Азербайджана, Киргизии и Казахстана. Критерии включения: подписанное информированное согласие на включение в программу; перенесенный COVID-19 (верифицированный результатами ИФА или ПЦР); появление стойких жалоб (от 1 мес до 1 года) после перенесенного COVID-19, ранее нехарактерных для пациента; наличие клинических проявлений ПКС в виде астенического синдрома (значения по одной из субшкал MFI выше 12 баллов) и умеренного когнитивного расстройства (по шкале MMSE 25—28 баллов); возраст от 18 до 80 лет. Критерии невключения: ОРВИ и COVID-19 в острой стадии заболевания; выраженные когнитивные и психические нарушения; тяжелое или нестабильное течение артериальной гипертензии (АГ), уровень артериального давления (АД) выше 200/115 мм рт.ст.; декомпенсированные соматические заболевания — ишемическая болезнь сердца (ИБС), хроническая легочная, почечная и печеночная недостаточность, онкологические заболевания; прочие (несосудистые) заболевания центральной нервной системы; острое нарушение мозгового кровообращения в течение последнего месяца перед включением в исследование; возраст до 18 и старше 80 лет; беременность и кормление грудью; наличие грубого двигательного или сенсорного дефекта и иных тяжелых заболеваний или состояний, которые, по мнению врача-исследователя, могут искажать результаты наблюдательной программы и ограничивать участие пациента в исследовании; непереносимость компонентов препарата, лекарственная аллергия или наличие противопоказаний к приему препарата Кортексин. Критерии исключения: возникновение любого состояния, входящего в критерии невключения; нарушение протокола; возникновение индивидуальной непереносимости препарата; просьба больного или его родственников; возникновение любого медицинского (в том числе серьезного нежелательного явления — НЯ) или социального (смена места жительства, длительная командировка) события, вынуждающего прекратить участие в данном исследовании.
В исследование включены 979 пациентов, перенесших COVID-19, средний возраст 54,6±14,5 (от 18 до 80 лет) года, 328 мужчин и 651 женщина. Давность перенесенного SARS-CoV-2 от 1 до 12 мес (рис. 1). Диагноз COVID-19 был подтвержден методами ПЦР у 405 пациентов, ПЦР и КТ органов грудной клетки — у 212, у остальных — результатами ИФА и/или компьютерной томографии (КТ) легких (у 100 пациентов КТ органов грудной не проводилась). У 258 (26,4%) пациентов поражение легких по данным КТ составило <25%, у 519 (53,1%) — поражение легких отсутствовало, у 111 (11,3%) — степень поражения <50%, у 15 (1,5%) — от 51 до 100%. Большинство пациентов перенесли инфекцию легкой или средней степени тяжести. Треть пациентов проходили лечение в стационаре, из них 10 находились в отделении реанимации и интенсивной терапии. Всем проводилась специфическая терапия по поводу COVID-19, 464 (47,4%) пациента при наличии показаний получали терапию по поводу сопутствующих заболеваний (антигипертензивные, сахароснижающие и антитромботические препараты, статины).
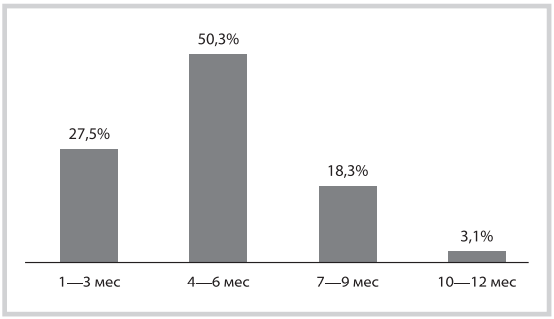
Рис. 1. Распределение пациентов в зависимости от давности COVID‑19.
Fig. 1. Distribution of patients depending on the age of COVID‑19.
У всех пациентов имелись жалобы, сохраняющиеся длительное время после перенесенной инфекции, не связанные с другими заболеваниями, подтвержденные результатами обследования и консультацией профильных специалистов: терапевта, кардиолога, эндокринолога, ревматолога, офтальмолога, отоларинголога, трихолога. Пациенты с выраженными >3 мес депрессивно-тревожными расстройствами консультировались психотерапевтом/психиатром.
Среди сопутствующих заболеваний у 525 (53,6%) пациентов имелась АГ, у 133 (13,6%) — сахарный диабет, у 262 (26,8%) — атеросклероз, у 248 (25,3%) — ХИМ, у 124 (12,7%) — ИБС, у 61 (6,2%) — хронические заболевания легких, у 224 (22,9%) — хронические заболевания желудочно-кишечного тракта, у 437 (44,6%) — болевые синдромы (боль в спине, суставах, головная боль).
Все пациенты были обследованы на трех визитах: на 1-м в день обращения в медицинское учреждение проводилась оценка жалоб, анализ значений физиологических показателей (систолическое и диастолическое АД, пульс), скрининг на соответствие критериям включения. Назначался Кортексин на 10 дней, 584 (59,6%) пациента получали 10 мг в/м, 395 (40,4%) — 20 мг в/м, выбор дозы проводился методом случайной выборки. На 2-м визите на 10 — 14-е сутки проводился телефонный опрос для выявления наличия/отсутствия положительной клинической динамики, НЯ. На 3-м визите (очном) на 30-е сутки оценивались динамика жалоб, показатели клинической картины. Пациенту предлагалось провести субъективную оценку качества лечения. Для оценки состояния больных использовались шкала оценки астении (MFI-20), краткая шкала оценки психического статуса (Mini-Mental State Examination, MMSE), проба Шульте. Регистрировали все побочные эффекты и НЯ, возникшие в период лечения, частоту и характер, их связь с исследуемым препаратом.
Статистическую обработку результатов осуществляли с помощью программ Statistica 10 («StatSoft Inc», США) и Microsoft Excel с вычислением уровня значимости (p). Для отличного от нормального распределения показателей использовали непараметрический анализ (для сравнения двух независимых групп по порядковым и количественным признакам применяли тест Манна—Уитни). Результаты представлены в виде медианы, 25% и 75% квартилей, Me [25%; 75%]. Статистически значимыми считались различия при вероятности ошибки первого рода <5% (p<0,05).
Установлено, что ежедневно к врачам обращались с жалобами после перенесенного COVID-19 в среднем до 5 пациентов (до 30% в общей структуре амбулаторного неврологического приема). Около 2% неврологов отметили более частое обращение — от 6 до 10 в день. Среди наиболее используемых лекарственных препаратов, назначаемых для коррекции последствий COVID-19, были антиоксиданты, витамины группы B, цитиколин, антидепрессанты, анксиолитики. У всех обследуемых пациентов имелись астенические расстройства, снижение концентрации внимания, утомляемость, головокружение, нарушение сна, раздражительность, характерные для любой перенесенной вирусной инфекции, но для COVID-19 более выраженные в первые 12 нед после острой фазы. По мнению пациентов, они наблюдались и в более поздние сроки, причем снижение памяти и концентрации внимания развивалось не сразу, было отсроченным во времени, что затрудняло установление его связи с COVID-19.
Наиболее частыми оказались жалобы на снижение концентрации внимания (100,0%), повышенную утомляемость (97,5%), общую слабость (93,7%), забывчивость (92,4%), тревожность (89,9%), нарушение сна (81,7%), нарушение обоняния (74,4%), головокружение (70,9%), раздражительность (69,6%), головную боль (69,6%), шум в ушах (41,8%), чувство страха (44,3%), плаксивость (38,0%) и др. (одышка, болевые синдромы, повышенная потливость, аносмия, гипосмия, дизосмия, парестезии, выпадение волос, ухудшение зрения, нестабильное АД, тахикардия, аллергические реакции) — 31,6%. Подобные жалобы отмечали и другие исследователи. По клиническим характеристикам, особенно у пожилых пациентов, постковидные нарушения психики были тождественны проявлениям постинсультной депрессии. Нарушения обмена нейротрансмиттеров (их недостаточная или, напротив, чрезмерная продукция) являются причиной дезорганизации синаптических процессов и наблюдаются после вирусной инфекции, что коррелирует с временным ухудшением памяти и снижением концентрации внимания.
Во время телефонного анкетирования на 2-м визите все пациенты, получавшие разные дозы Кортексина, отметили улучшение состояния, уменьшение выраженности или регресс жалоб, отсутствие НЯ и побочных эффектов терапии. Все опрошенные подтвердили дальнейшее участие в наблюдательной программе. Третий визит позволил объективизировать полученную по телефону информацию. Все пациенты отмечали улучшение общего состояния, повышение физической и психической активности, улучшение работоспособности независимо от дозировки Кортексина (рис. 2). У больных, получавших Кортексин по 10 мг, утомляемость уменьшилась почти в 3 раза p<0,001), общая слабость — в 4,6 раза (p=0,004). У больных, получавших Кортексин по 20 мг, динамика была более выражена: утомляемость уменьшилась в 3,6 раза (p<0,001), общая слабость — в 5,1 раза (p<0,001). Головная боль, головокружение и шум в ушах, которые трудно расценить как проявления только ПКС, также регрессировались у большинства больных и не проявлялись спустя 1 мес терапии (p<0,001). Диагностика и коррекция таких состояний важны, так как представляют собой частые жалобы, снижающие качество жизни пациентов и приверженность к терапии.
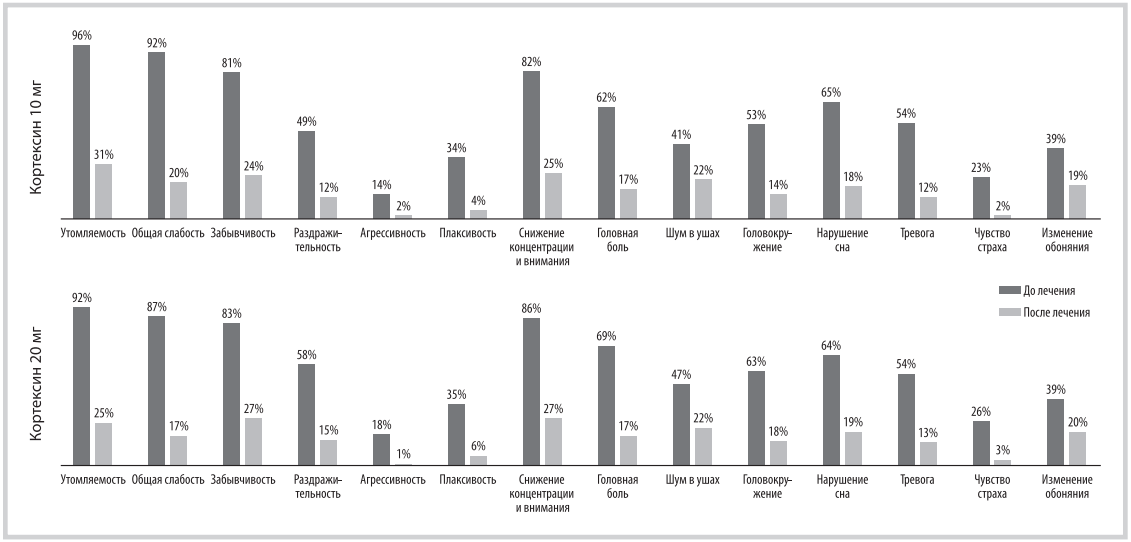
Рис. 2. Динамика жалоб у наблюдавшихся пациентов в зависимости от дозы Кортексина.
Fig. 2. Dynamics of complaints in patients undergoing COVID‑19 depending on the dose of Cortexin.
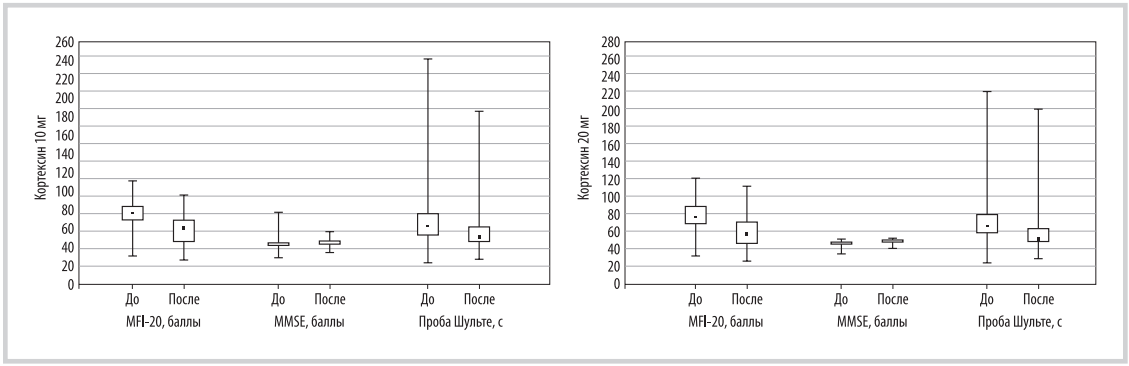
Рис. 3. Динамика состояния больных в зависимости от дозы Кортексина.
Fig. 3. Dynamics of patients’ condition depending on the dose of Cortexin.
Учитывая, что 74% пациентов с ПКС предъявляют жалобы на нарушение обоняния, в рамках исследования отдельно оценивалась динамика таких жалоб. Были получены следующие результаты: в обеих группах после лечения уменьшились нарушения обоняния в 2 раза (p<0,001). Использование нейротрофических факторов, вероятно, может «спасать» дегенерирующие нейроны и стимулировать рост аксонов и дендритов, формировать образование новых связей после вирусной инфекции.
Противотревожная, антидепрессивная и анксиолитическая активность Кортексина проявлялась уже на 2-м визите, сохранялась к 3-му визиту, хотя в предыдущих публикациях, посвященных лечению пациентов с ХИМ, эти эффекты отмечены только при назначении повторных курсов терапии.
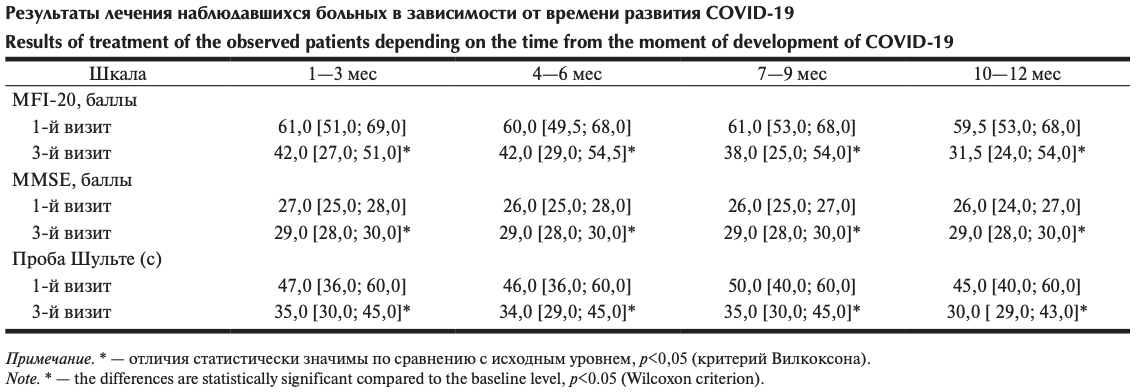
Применение Кортексина в различных дозировках приводило к статистически значимой коррекции когнитивных нарушений и уменьшало выраженность астении вне зависимости от длительности течения ПКС (см. таблицу). Выраженная положительная динамика со стороны проявлений астении, когнитивного статуса наблюдалась у всех пациентов, более выраженный эффект имел место у пациентов, получавших 20 мг Кортексина (рис. 3). Положительный эффект наблюдался вне зависимости от времени начала лечения после перенесенного COVID-19.
Все пациенты оценили эффективность проведенного лечения как высокую по показателям субъективной шкалы оценки качества лечения. Случаев лекарственного взаимодействия Кортексина и других препаратов, принимавшихся наблюдаемыми больными, НЯ отмечено не было.
Проведенная многоцентровая клинико-эпидемиологическая наблюдательная программа подтвердила данные о высокой распространенности постковидного синдрома и значительной вариабельности клинической картины с превалированием астенических расстройств. Не выявлено достоверной корреляции клинической симптоматики со степенью тяжести COVID-19, процентом поражения легочной ткани, разными сроками после острой фазы. Показана эффективность препарата Кортексин для коррекции астенических и когнитивных симптомов у пациентов с ПКС. Эффективность обеих дозировок Кортексина проявляется уже к 10—14-му дню лечения и сохраняется до 1 мес. За время наблюдения ни у одного пациента не было отмечено НЯ и неблагоприятных лекарственных взаимодействий с другими препаратами. Выявлен дозозависимый эффект Кортексина в отношении астенических и тревожно-депрессивных расстройств, но не когнитивных нарушений. Высокая эффективность Кортексина в отношении коррекции когнитивных нарушений, астении, наличие анксиолитического эффекта, отсутствие побочных эффектов, совместимость с другими лекарственными средствами дают основание рассматривать возможность его назначения для лечения пациентов с ПКС.
Shah W, Hillman T, Playford ED, Hishmeh L. Managing the long-term effects of COVID-19: a summary of the recommendations NICE and RCGP. BMJ. 2021;372:136-140. https://doi.org/10.1136/bmj.n13
Huang C, Huang L, Wang Y, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220-232. https://doi.org/10.1016/S0140-6736(20)32656-8
Chopra B, Flanders SA, O’Malley M. Sixty-day results among patients hospitalized with COVID-19. Ann Intern Med. 2021;174:576-578. https://doi.org/10.7326/M20-5661
Crook H, Raza S, Nowell J, et al. Long covid — mechanisms, risk factors, and management. BMJ. 2021;374:n1648. https://doi.org/10.1136/bmj.n1648
Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome. Nat Med. 2021;27(4):601-615. https://doi.org/10.1038/s41591-021-01283-z
Клинические рекомендации МЗ РФ по профилактике, диагностике и лечению новой коронавирусной инфекции COVID-19; 13 версия (4.10.2021):238. Clinical guidelines of the Ministry of Health of the Russian Federation for the prevention, diagnosis and treatment of a new coronavirus infectionCOVID-19 version 13: 238. (In Russ.). https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/058/211/original/BMP-13.pdf
Путилина М.В., Теплова Н.В., Баирова К.И. и др. Эффективность и безопасность Цитофлавина при реабилитации больных с постковидным синдромом: результаты проспективного рандомизированного исследования ЦИТАДЕЛЬ. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(10):39-45. Putilina MV, Teplova NV, Bairova KI, et al. The result of prospective randomized study CITADEL — the efficacy and safety of drug Cytoflavin in postcovid rehabilitation. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2021;121(10):39-45. (In Russ.). https://doi.org/10.17116/jnevro202112110139
Путилина М.В. Астенические расстройства как проявление синдрома хронической усталости. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(8):119-124. https://doi.org/10.17116/jnevro2021121081119 Putilina MV. Asthenic disorders as a manifestation of chronic fatigue syndrome. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2021;121(8):119-124. (In Russ.). https://doi.org/10.17116/jnevro2021121081119
Soudy R, Kimura R, Patel A. Short amylin receptor antagonist peptides improve memory deficits in Alzheimer’s disease mouse model. Sci Rep. 2019;9:10942. https://doi.org/10.1038/s41598-019-47255-9
Путилина М.В., Гришин Д.В. SARS-CoV-2 (COVID-19) как предиктор нейровоспаления и нейродегенерации. Потенциальные стратегии терапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020;120(8):58-64. Putilina MV, Grishin DV. SARS-CoV-2 (COVID-19) as a predictor of neuroinflammation and neurodegeneration: potential therapy strategies. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2020;120(8):58-64. (In Russ.). https://doi.org/10.17116/jnevro202012008258
Zhou X, Smith QR, Liu, X. Brain-penetrating peptides and peptide-drug conjugates for overcoming the blood-brain barrier and combating diseases of the central nervous system. WIRES Nanomed Nanobiotechnol. 2021;6:e1695. https://doi.org/10.1002/wnan.1695
Lee J, Kim C. Peptide Materials for Smart Therapeutic Applications. Macromol Res. 2021;29:2-14. https://doi.org/10.1007/s13233-021-9011-x
Lee J, Zheng M, Shimoni O, et al. Development of New Therapeutics Aimed at blood-brain barrier: from barrier to carrier. Adv Sci. 2021;8:21-28. https://doi.org/10.1002/advs.202101090
Яковлев А.А., Гуляева Н.В. Молекулярные партнеры Кортексина в мозге. Нейрохимия. 2017;33:1:91-96. Yakovlev AA, Gulyaeva NV. Molecular partners of cortexin in the brain. Neurochemistry. 2017;33:1:91-96. (In Russ.). https://doi.org/10.1134/S1819712416040164
Нестеренко А.Н., Онуфриев М.В., Гуляева Н.В.и др.Влияние препарата Кортексин на свободнорадикальное окисление и воспалительные процессы у крыс с нормальным и ускоренным старением. Нейрохимия. 2018;2(35):187-198. Nesterenko AN, Onufriev MV, Gulyaeva NV, et al. Effect of the drug Cortexin on free radical oxidation and inflammatory processes in rats with normal and accelerated aging. Neurochemistry. 2018;2(35):187-198. (In Russ.). https://doi.org/10.7868/S1027813318020127.
Цыган В.Н. Синдром хронической усталости и его коррекция Кортексином. РМЖ. 2010;16:1004-1008. Tsygan VN. Chronic fatigue syndrome and its correction with Cortexin. Russian Medical Journal. 2010;16:1004-1008. (In Russ.).
Ludewig P, Winneberger J, Magnus T. The cerebral endothelial cell as a key regulator of inflammatory processes in sterile inflammation. J Neuroimmunol. 2019;326:38-44. https://doi.org/10.1016/j.jneuroim.2018.10.012
Kurkin D, Bakulin D, Morkovin E. et al. Neuroprotective action of Cortexin, Cerebrolysin and Actovegin in acute or chronic brain ischemia in rats. PLoS ONE. 2021;16(7):E0254493. https://doi.org/10.1371/journal.pone.0254493
Путилина М.В., Вечорко В.И., Гришин Д.В., Сидельникова Л.В. Острые нарушения мозгового кровообращения, ассоциированные с коронавирусной инфекцией SARS-CoV-2 (COVID-19). Журнал неврологии и психиатрии им. С.С. Корсакова. 2020;120(12):109-118. Putilina MV, Vechorko VI, Grishin DV, Sidelnikova LV. Acute cerebrovascular accidents associated with SARS-CoV-2 coronavirus infection (COVID-19) Journal of Neurology and Psychiatry. S.S. Korsakov. 2020;120(12):109-118. (In Russ.). https://doi.org/10.17116/jnevro2020120121109
Путилина М.В., Солдатов М.А. Церебральные инсульты в старческом возрасте. Особенности клинической картины, течение, лечение. Врач. 2006;5:29-34. Putilina MV, Soldatov MA. Cerebral strokes in old age. Features of the clinical picture, course, treatment. Doctor. 2006;5:29-34. (In Russ.).
Serebrovska ZO, Chong EY, Serebrovska TV. Hypoxia, HIF-1α, and COVID-19: from pathogenic factors to therapeutic targets. Acta Pharmacol Sin. 2020;41:1539-1546. https://doi.org/10.1038/s41401-020-00554-8
Pavli A, Theodoridou M, Maltezou HC. Post-COVID syndrome: Incidence, clinical spectrum, and challenges for primary healthcare professionals. Arch Med Res. 2021:S0188-4409(21)00081-3. https://doi.org/10.1016/j.arcmed.2021.03.010.
Путилина М.В., Баранова О.А. Результаты многоцентровой клинико-эпидемиологической наблюдательной программы «ГЛОБУС» (определение распространенности головокружения и оценка схем терапии на амбулаторном уровне). Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(5):33-38. Putilina MV, Baranova OA. Results of the multicenter clinical and epidemiological observational program «GLOBUS» (determination of the prevalence of dizziness and assessment of therapy regimens at the outpatient level). Journal of Neurology and Psychiatry. S.S. Korsakov. 2014;114(5):33-38. (In Russ.).
Zhang J, Zhou Y. 14-3-3 Proteins in Glutamatergic Synapses. Hindawi Neural Plasticity. 2018;23:23-29. https://doi.org/10.1155/2018/8407609
Путилина М.В., Теплова Н.В., Порядин Г.В. Перспективы фармакологического кондиционирования нейроваскулярной единицы в условиях нейротропной вирусной инфекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(5):89-95. Putilina MV, Teplova NV, Poryadin GV. Prospects for pharmacological adaptation of neurovascular unit in conditions of neurotropic viral infection. S.S. Korsakov Journal of Neurology and Psychiatry. 2021;121(5):89-95. (In Russ.). https://doi.org/10.17116/jnevro2021121051144
Федин А.И., Бельская Г.Н., Курушина О.В. и др. Дозозависимые эффекты кортексина при хронической ишемии головного мозга (результаты многоцентрового рандомизированного контролируемого исследования). Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(9):35-42. Fedin AI, Bel’skaia GN, Kurushina OV, et al. Dose-dependent effects of cortexin in chronic cerebral ischemia (results of a multicenter randomized controlled study). Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2018;118(9):35-42. (In Russ.). https://doi.org/10.17116/jnevro201811809135