Подтвердите, пожалуйста, являетесь ли Вы дипломированным специалистом в сфере здравоохранения?
СОГЛАСНО ДЕЙСТВУЮЩЕМУ ЗАКОНОДАТЕЛЬСТВУ ИНФОРМАЦИЯ, ПРЕДОСТАВЛЕННАЯ В ДАННОМ РАЗДЕЛЕ, ПРЕДНАЗНАЧЕНА ИСКЛЮЧИТЕЛЬНО ДЛЯ ДИПЛОМИРОВАННЫХ СПЕЦИАЛИСТОВ В СФЕРЕ МЕДИЦИНЫ И ФАРМАЦЕВТИКИ
А.И. ФЕДИН, Г.Н. БЕЛЬСКАЯ, О.В. КУРУШИНА, В.В. КОВАЛЬЧУК, Е.В. СТАРЫХ, Л.В. ЧИЧАНОВСКАЯ, О.А. БАРАНОВА
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Минздрава России, Москва, Россия;
ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия;
ФГБОУ ВО «Волгоградский государственный медицинский университет», Минздрава России, Волгоград, Россия;
Центр медицинской реабилитации СПб ГБУЗ «Городская больница №38 им. Н.А. Семашко», Санкт-Петербург, Россия;
ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России, Тверь, Россия
Цель исследования. Изучение дозозависимого эффекта кортексина при неврологических нарушениях и его влияния на некоторые звенья ишемического каскада (выраженность окислительного стресса) при хронической ишемии мозга (ХИМ) I—II стадии.
Материал и методы. Обследовали 189 больных (42 мужчин и 147 женщин) с ХИМ; средний возраст 64,3±0,5 года. Больные были разделены на три группы: пациентам 1-й группы было назначено внутримышечное введение 20 мг кортексина в сутки, 2-й группы — 10 мг в сутки, 3-я группа (сравнения) получала базовую терапию. Первый курс лечения продолжался 10 сут, повторный проводили через 6 мес. До лечения и в процессе наблюдения (5 визитов) проводили общее клиническое и неврологическое обследования с применением следующих шкал: амбулаторной шкалы хронической ишемии мозга А.И. Федина, астении MFI-20, сна Шпигеля, депрессии Цунга, тревоги Спилбергера, а также нейропсихологические тесты («рисование часов» и «5 слов»). Выраженность окислительного стресса определялась по содержанию восстановленных SH-групп.
Результаты и заключение. Выявлено дозозависимое терапевтическое действие препарата на общую выраженность неврологических нарушений, астенический синдром, диссомнию. Динамика когнитивных показателей была выраженной в обеих группах,получавших терапию кортексином, но не зависела от дозировки препарата. Антидепрессивный и анксиолитический эффекты были незначительными и проявляли себя после назначения повторных курсов препарата. Данные лабораторных исследований подтвердили не зависевшее от дозы антиоксидантное действие кортексина. Была подтверждена безопасность применения препарата и его хорошая переносимость.
Ключевые слова: хроническая ишемия мозга, нейропептиды, кортексин.
Раннее выявление и лечение хронических форм цереброваскулярной болезни (ЦВБ) имеет большое значение для предупреждения их прогрессирования и профилактики инсульта. По данным статистики, в 2016 г. в Российской Федерации заболеваемость болезнями системы кровообращения (БСК) составила 4648,8 на 100 000, среди которых 1116,2 (24,0%) приходилось на ЦВБ, смертность от БСК — 47,8% от всех случаев с летальным исходом, при этом в структуре БСК доля ЦВБ составила 31,0%.
Данных государственной статистики о структуре заболеваемости ЦВБ в нашей стране нет. Имеются отдельные публикации, свидетельствующие о том, что ведущее место среди всех ЦВБ занимают хронические формы. Так, например, в Москве, по данным отдела статистики Департамента здравоохранения, ежегодно регистрируется от 35 до 40 тыс. новых инсультов, в то время как пациентов с хроническими формами ЦВБ выявлено около 800 тыс. По данным Научного центра неврологии, распространенность хронических форм ЦВБ составляет 70—100 больных на 1000 населения.
Патогенез поражения церебральных структур при хронических сосудистых заболеваниях головного мозга, несмотря на многообразие вызывающих их причин, всегда заключается в последовательном нарастании комплекса патобиохимических расстройств, обусловленных снижением мозгового кровотока и развитием ишемического каскада. Избыточная вследствие ишемии мозга активация глутаматергической системы приводит к массивному поступлению в нейроны ионов кальция и натрия, деполяризации клеточных мембран, активации вольтажзависимых кальциевых каналов и внутриклеточному накоплению кальция, в результате чего начинаются неблагоприятные патобиохимические процессы с лактатацидозом, активацией внутриклеточных ферментов, повышением синтеза оксида азота и развитием окислительного стресса.
Лечение пациентов с хронической ишемией мозга (ХИМ), исходя из патогенеза заболевания, включает гипотензивную и гиполипидемическую терапию (по показаниям), курсовое назначение цереброваскулярных, антиагрегантных, нейрометаболических и нейропротективных препаратов, антиоксидантов.
Концепция нейротрофической терапии связана с плейотропной ролью нейротрофинов и ростовых факторов в регуляции функций мозга. Нейротрофины и ростовые факторы относятся к физиологически значимым полипептидам, которые регулируют рост и дифференцировку нейронов, их функциональную стабильность и синаптическую пластичность. Регуляторные нейропептиды участвуют в передаче клеткам биологически важной информации, облегчая вне-, внутриклеточные и внутритканевые взаимодействия, а также способствуют активации репаративных и регенераторных клеточных механизмов. Большинство нейропептидов способно активировать образование различных факторов роста, таких как фактор роста нервов, мозговой нейротрофический фактор, нейротрофин-3 и другие пептиды этого семейства.
Основной механизм действия нейротрофинов связан с контролированием апоптоза — процесса «программируемой» гибели клеток, организацией ионного баланса кальциевых, натриевых и калиевых каналов, поддержанием взаимодействия различных групп нейронов. Малые нейропептиды содержат сигнальные молекулы — эндогенные химические соединения, обеспечивающие внешнее управление метаболизмом клеток-мишеней при взаимодействии с рецепторами этих клеток. Регуляторные белки сигналинга составляют непрерывную цепь разнообразных процессов регуляции от синапса до аппарата ДНК в нейроне. В связи с этим концепция нейротрофической терапии, связанная с плейотропным действием нейротрофинов и ростовых факторов в регуляции функций головного мозга, является крайне перспективной.
Одним из средств нейротрофического и нейропротективного действия является кортексин(ООО «ГЕРОФАРМ», Россия) — многокомпонентный препарат с оптимальным сбалансированным составом полипептидов, амино- и рибонуклеиновых кислот, оказывающий тканеспецифичное воздействие на головной мозг. Препарат был разработан в Военно-медицинской академии им. С.М. Кирова и проходил доклинические исследования в Институте биорегуляции и геронтологии (Санкт-Петербург).
Кортексин представляет собой лиофилизат, получаемый путем уксусной экстракции пептидов и других компонентов из коры головного мозга крупного рогатого скота и свиней. Гель-хроматография образцов кортексина выявила в его составе до 90% олиго- и коротких пептидов и около 10% различных аминокислот. Разработанная технология получения специфических нуклеопротеиновых комплексов позволяет сохранять структурные элементы хроматина с комплементарными участками ДНК. Кортексин содержит также набор микроэлементов, важных для жизнедеятельности клетки. Входящие в его состав низкомолекулярные пептиды при внутримышечном введении проходят гематоэнцефалический барьер. В эксперименте выявлены белки, обеспечивающие нейросигналинг препарата. К ним относятся четыре белка головного мозга, вступающие во взаимодействие с пептидами кортексина: три нейронспецифичных белка (тубулин β5, креатинкиназа типа В и белок 14-3-3 α/β), а также распространенный во многих тканях белок цитоскелета актин. Их функции объясняют нейробиологические процессы, связанные с нейросигналингом кортексина. Актиновый цитоскелет регулирует важнейшие клеточные процессы в мозге, включая деление и пролиферацию, миграцию клеток, цитокинез и дифференцировку. Нейронспецифичный белок тубулин β5 является критическим для возникновения и созревания нейронов, их миграции, дифференцировки и встраивания в нервные сети. Белок 14-3-3 α/β влияет на разные клеточные и физиологические процессы, осуществляет нейропротективные функции при нейродегенеративных и других неврологических заболеваниях. Повышение активности фермента креатинкиназы обеспечивает позитивный эффект препарата на энергообеспечение тканей ЦНС. Кроме того, кортексин препятствует образованию свободных радикалов. Кортексинобладает целым рядом потенциально полезных свойств, необходимых при лечении ХИМ. Прежде всего это связано с активацией нейротрофических факторов мозга. Кроме того, под действием кортексина происходят оптимизация баланса метаболизма возбуждающих и тормозных аминокислот, дофамина, серотонина, ГАМКергическое воздействие, что в целом проявляется снижением уровня пароксизмальной готовности мозга.
Терапевтическое действие кортексина при ЦВБ было изучено в ряде клинических исследований, в том числе и в восстановительном периоде инсульта. Показано, что применение препарата в схеме комплексной реабилитации способствует улучшению когнитивных функций. Выраженное и удовлетворительное улучшение суммарно отмечено у 66% пациентов, получавших терапию кортексином, что в 2 раза превышает показатели в группе контроля. Аналогичные данные получены в открытом клиническом исследовании препарата при дисциркуляторной энцефалопатии. При исследовании биомаркеров ишемии головного мозга в виде антител к NMDA-рецепторам до и после 10-суточного курса лечения низкими дозами кортексина (10 мг/сут) была выявлена достоверная корреляция его терапевтического эффекта и содержания биомаркеров в сыворотке крови.
Исследователями российской многоцентровой наблюдательной программы КОРМЕН была установлена эффективность кортексина и мемантина в коррекции когнитивных нарушений у пациентов с ХИМ. При этом были получены данные о синергизме действий кортексина и мемантинола (мемантин).
В литературе имеются также сообщения о терапевтической эффективности и безопасности кортексина в более высоких дозировках — 20 мг/сут. В таком режиме дозирования он применялся при острых, критических и неотложных состояниях (острейший период острого нарушения мозгового кровообращения, коматозное и вегетативное состояния после повреждения головного мозга и др.), а также в периоды реабилитации после инсультов (ранний и отдаленный восстановительные периоды) и при ХИМ. Но сравнение особенностей действия разных дозировок кортексина при ХИМ не проводилось.
Таким образом, возникла необходимость проведения многоцентрового рандомизированного контролируемого исследования по изучению эффективности и безопасности применения кортексина 10 и 20 мг у больных с ХИМ I—II стадии.
Цель настоящего исследования — изучение дозозависимого эффекта кортксина при внутримышечном введении (10 или 20 мг) на выраженность неврологических нарушений, оценка его влияния на некоторые звенья ишемического каскада (показатели окислительного стресса) при ХИМ I—II стадии, а также безопасность и переносимость препарата.
Исследование было проведено в 5 клинических неврологических центрах, расположенных в Москве, СанктПетербурге, Волгограде, Твери и Челябинске в период с 2016 по 2018 гг.
В исследование были включены 189 больных с диагнозом, соответствующим шифру I67.8 МКБ-10 «Хроническая ишемия мозга (недифференцированная)» I—II стадии (30 баллов по краткой шкале психического статуса — MiniMental State Examination; MMSE). В числе больных были 42 (22,2%) мужчины и 147 (77,8%) женщин. Средний возраст пациентов составил 64,3±0,5 года. Преобладали (67,2%) лица пожилого и старшего возраста (60—80 лет), что соответствует демографической характеристике больных с сердечно-сосудистыми заболеваниями.
Критериями включения в исследование: подписанное информированное согласие на участие в исследовании; возможность и желание находиться под наблюдением врача-исследователя в течение предусмотренного протоколом времени; возраст 50—80 лет; отсутствие в анамнезе инсульта; отсутствие грубого двигательного или сенсорного дефекта или иных нарушений, которые могут затруднить оценку первичных или вторичных переменных; отсутствие тяжелых или нестабильных соматических заболеваний; отсутствие других клинически значимых неврологических или психических заболеваний; наличие на МР-томограмме головного мозга признаков ХИМ (лейкоареоз, ишемические кисты, атрофия вещества мозга).
Критерии невключения: противопоказания к назначению кортексина; наличие инсульта и черепно-мозговой травмы в анамнезе за период времени не менее полугода до включения; грубые двигательные или сенсорные дефекты и иные нарушения, которые могут затруднить оценку состояния; тяжелые или нестабильные по тяжести соматические заболевания; другие клинически значимые неврологические и психические заболевания; прием за 3 мес до включения препаратов, обладающих нейропротективным, антиоксидантным, цереброваскулярным, антидепрессивным и анксиолитическим действием
Включенные в исследование больные были рандомизированы методом случайной выборки на три группы, после чего пациенты каждой группы амбулаторно или в стационаре дневного пребывания получали курс лечения исследуемым препаратом.
В 1-ю группу вошли 69 пациентов, которым было назначено внутримышечное введение 20 мг кортексина 1 раз в сутки, 2-ю группу составили 68 больных, которые получали препарат в дозе 10 мг 1 раз в сутки, в 3-ю группу (сравнения) включили 52 пациентов, которым была проведена только базовая терапия без применения нейропротективных, антиоксидантных и цереброваскулярных препаратов. Курс лечения во всех группах продолжался 10 сут и был повторен через 6 мес (1-й и 2-й курсы терапии)
Обследование больных осуществлялось в течение 5 визитов: до лечения — 1-й визит (исходный); после окончания 1-го курса терапии — 2-й визит; через 90 сут после начала 1-го курса — 3-й визит; через 180 сут после начала 1-го курса — 4-й визит; после окончания 2-го курса лечения — 5-й визит (заключительный).
При обследовании, помимо общеклинических и неврологических методов оценки состояния больных, использовали ряд шкал: амбулаторную шкалу ХИМ А.И. Федина, субъективную шкалу оценки астении (Multidimensional Fatigue Inventory — MFI-20), шкалу оценки субъективных характеристик сна Шпигеля, шкалу самооценки депрессии Цунга, шкалу тревожности (ситуационной и личностной) Спилбергера, а также нейропсихологические тесты — «рисование часов» (с оценкой по 10-балльной шкале) и тест «5 слов».
Амбулаторная шкала ХИМ А.И. Федина (2016) подразделяется на подшкалы: «общемозговые и астенические синдромы», «черепные нервы», «двигательная система (при отсутствии пареза конечностей)», «речь и другие когнитивные функции», «аффективные нарушения», что позволяет оценивать в баллах каждый из этих синдромов и проводить общую оценку выраженности неврологических нарушений.
У 30 больных (по 15 пациентов 1-й и 2-й групп) до лечения и после 1-го курса терапии было проведено лабораторное изучение выраженности окислительного стресса по показателям содержания восстановленных SH-групп и активности общей супероксидисмутазы.
Статистический анализ проводился при помощи статистического пакета программы SPSS-16. Статистическая значимость различий между подгруппами оценивалась с помощью критерия χ2 Пирсона и критерия Манна—Уитни для независимых выборок при p<0,05. При оценке статистической значимости в подгруппах между визитами использовался критерий знаковых рангов Вилкоксона для связанных выборок. Различия признавались значимыми при p<0,05.
В таблице представлена динамика средних значений изученных показателей в трех группах пациентов. Далее каждая группа рассматривается отдельно.
1-я группа
В 1-й группе по шкале ХИМ Федина средний показатель уменьшился уже после 1-го курса терапии с 38,36±2,98 до 25,72±1,99 балла (р=0,001). При 3-м и 4-м визитах он также был меньше исходного показателя, но без достоверных различий между ними. После 2-го курса лечения отмечалось более выраженное снижение среднего показателя по сравнению со значениями 1-го курса терапии — до 13,65±1,38 балла (р=0,001). Основное снижение выраженности неврологических нарушений было отмечено в разделе шкалы «общемозговые и астенические синдромы».
По шкале MFI после 1-го курса лечения (2-й визит) было выявлено достоверное уменьшение выраженности астении на уровне р=0,001, при 2 последующих визитах также происходило снижение значений, но достоверных различий между ними не было (р<0,05). После 2-го курса терапии снижение показателя астении достигло статистической значимости (р=0,001).
Среднее значение показателей оценки сна по шкале Шпигеля, начиная с 3-го визита и в период следующих визитов закономерно повышалось и достигло максимума при 5-м визите (после окончания терапии).
Антидепрессивное действие препарата проявилось только после 2-го курса лечения, при 5-м визите (р=0,001).
При оценке показателей тревожности по шкале Спилбергера изменений ситуационной тревожности отмечено не было, а выраженность личностной тревожности уменьшилась только после 2-го курса терапии (р=0,001).
Как упоминалось выше, в настоящем исследовании применялись также два нейропсихологических теста, направленных на оценку когнитивных расстройств. По тесту «рисования часов» после 1-го курса терапии было отмечено ожидаемое увеличение соответствующего показателя (р=0,001), при 3-м и 4-м визитах он практически не менялся, но к 5-му визиту, после 2-го курса терапии он снова возрос, достигнув статистической достоверности по сравнению с периодом после 1-го курса лечения (р=0,001). Сходной была динамика показателей теста «5 слов», значение которого стало максимальным при 5-м визите, т.е. после 2-го курса лечения.
2-я группа
У больных 2-й группы исходный средний показатель по шкале ХИМ Федина равнялся 31,01±2,13 балла. После 1-го курса терапии он достоверно снизился (р=0,001). При его оценке при 3-м и 4-м визитах было отмечено, что он оставался более низким по сравнению с исходным значением, но достоверных различий между визитами не наблюдалось (р>0,05). После 2-го курса терапии средний показатель по шкале Федина еще более снизился (17,72±1,3; р=0,001). Как и в 1-й группе, указанные изменения происходили главным образом за счет раздела шкалы «общемозговые и астенические синдромы».
Высоким во 2-й группе был и исходный балл по шкале MFI, который значительно снизился после 1-го курса лечения (р=0,001), при 3-м и 4-м визитах изменений по сравнению со 2-м визитом не было, но после 2-го курса терапии отмечалось более выраженнное снижение показателя астении (р=0,001).
При оценке динамики диссомнии по шкале Шпигеля установили, что положительное действие кортексина проявилось только при 4-м визите (р=0,007) и оно оказалось максимально выраженным после 2-го курса терапии (р=0,004).
По шкале Цунга показатели в процессе терапии колебались: они снизились ко времени 3-го визита (р=0,045), но при 4-м и 5-м визитах не отличались от исходных данных (р=0,22 и р=0,08 соответственно).
Динамика значений по шкале Спилбергера была выявлена только в отношении личностной тревоги: достоверное снижение показателей после 2-го курса терапии по сравнению с исходным и после 1-го курса лечения.
Нейропсихологические показатели по тестам «рисования часов» и «5 слов» на всех этапах лечения были лучше исходных (р=0,001), а после 2-го курса терапии превышали значения тестов, полученных после 1-го курса (р=0,001).
3-я группа
В 3-й группе по шкале ХИМ Федина общий исходный балл после 1-го курса лечения существенно снизился (p=0,001). При 3-м и 4-м визитах он также был меньше исходного показателя, но без существенной разницы между визитами (p>0,05). После 2-го курса лечения отмечалось еще более выраженное снижение этого показателя (p=0,001).
Начиная со 2-го визита установилась положительная динамика значений по шкале MFI (астения) (p<0,05).
Показатели шкалы сна Шпигеля достигли статистически достоверных по сравнению с исходными данными только к периоду 4-го и 5-го визитов (p=0,021 и p=0,016 соответственно).
Снижение показателя теста Цунга было отмечено при 5-м визите (p=0,018).
Динамики показателей по шкале Спилбергера выявлено не было (p>0,05).
Положительной была динамика когнитивных тестов «рисование часов» и «5 слов». Наиболее выраженные изменения были отмечены при 5-м визите (p=0,001 и p=0,046 соответственно).
После анализа показателей отдельных групп было проведено сравнение значений, полученных после окончания 2-го курса лечения (при 5-м визите), между группами и соотнесение их с исходными данными (1-й визит). Сравнение проводилось по критерию Манна—Уитни.
На рис. 1 представлена динамика показателей 5 шкал после окончания лечения по сравнению с исходными данными в процентах (взяты шкалы, по которым были выявлены наиболее значимые изменения).
Из приведенных на рис. 1 данных видно, что изменения показателей шкалы ХИМ Федина существенно различались в трех группах больных. В 1-й группе этот показатель равнялся — 54,9±3,8%, во 2-й группе — 39,6±3,8%
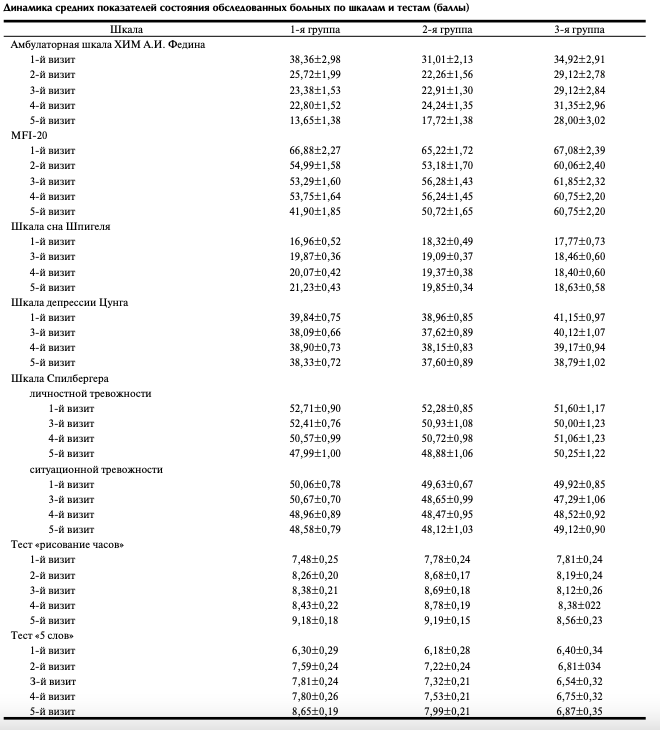
р=0,04), в 3-й группе — 23,1±5,1%. Различия по сравнению с исходными данными были статистически значимыми (р=0,001 и p=0,08 соответственно). Динамика показателей астении в 1-й группе была — 30,3±4,1%, 2-й — 19,8±2,7%, в 3-й — 12,3±3,6% (р=0,014; р=0,001; р=0,223 соответственно). В 1-й группе динамика значений по шкале Шпигеля равнялась 36,7±6,7%, во 2-й группе — 14,8±4,8% (р=0,001), в 3-й группе — 11,2±4,3% (р=0,007 и р=0,570 соответственно). Показатель по тесту «рисование часов» увеличился в 1-й группе на 40,4±12,5%, во 2-й группе — на 27,1±5,5% (р=0,308), в 3-й группе — на 11,5±2,4% (р=0,308, р=0,031 и р=0,292 соответственно).
Положительное изменение показателей теста «5 слов» в 1-й группе составляло 67,0±12,8%, во 2-й группе — 47,7±8,0%, в 3-й группе — 20,1±10,2% (р=0,371; р=0,001; р=0,001 соответственно).
Таким образом, у больных 1-й группы динамика указанных показателей была наиболее выраженной. По сравнению со 2-й группой, у пациентов 1-й группы статистически значимыми были отличия значений по шкале ХИМ
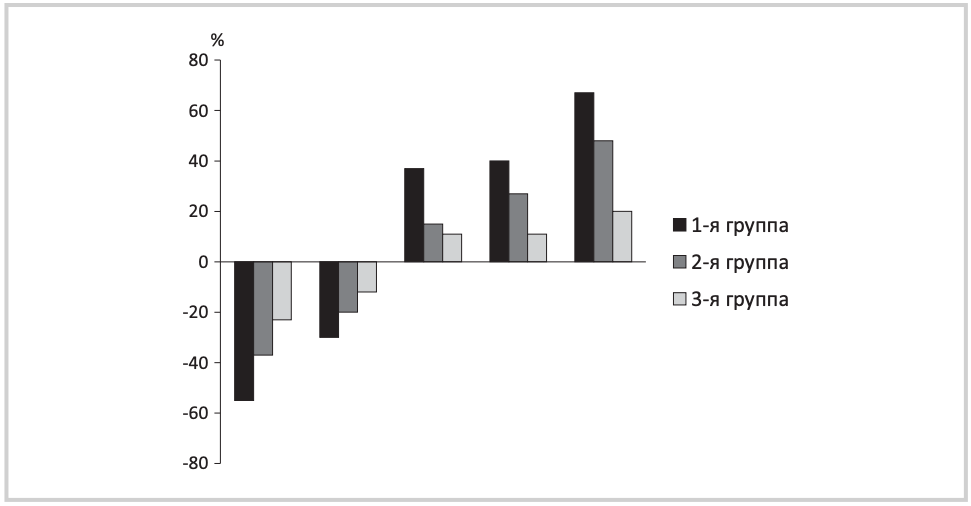
Рис. 1. Изменение показателей по шкалам при 5-м визите по сравнению с 1-м визитом у обследованных больных.
Первая группа столбцов — шкала ХИМ Федина; вторая — шкала MFI-20, третья — шкала сна Шпигеля; четвертая — тест «рисование часов», пятая — тест «5 слов».
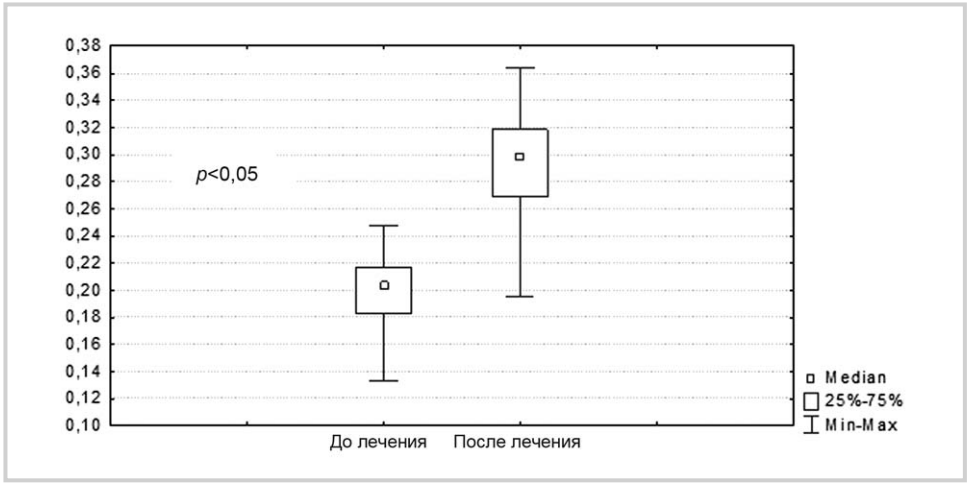
Рис. 2. Количество восстановленных SH-групп в плазме крови (m±M) при назначении 10 мг кортексина.
Федина, шкалам астении и нарушений сна. Динамика когнитивных тестов не выявила между этими группами статистических значимых различий (р>0,05). Наиболее выраженными и статистически значимыми были различия между 1-й и 3-й группами. Сравнение динамики показателей 2-й и 3-й групп показало большее, статистически значимое их изменение во 2-й группе по шкале ХИМ Федина и тесту «5 слов».
При оценке динамики показателей шкал аффективных расстройств (депрессия и тревога) существенных различий между 5-м и 1-м визитами, за исключением более выраженного понижения показателя личностной тревоги у больных 1-й группы по сравнению с 3-й группой (–6,0±1,9 и –1,2±2,3% соответственно; р=0,016), выявлено не было.
Оценка выраженности окислительного стресса, количества восстановленных SH-групп и активности общей супероксидисмутазы была проведена у 30 больных (по 15 больных 1-й и 2-й групп) до и после 10-суточного курса назначения кортексина. Плазменные концентрации восстановленных SH-групп отражают степень окисленности низкомолекулярных тиолсодержащих соединений плазмы крови (глутатион, цистеин и т.д.).
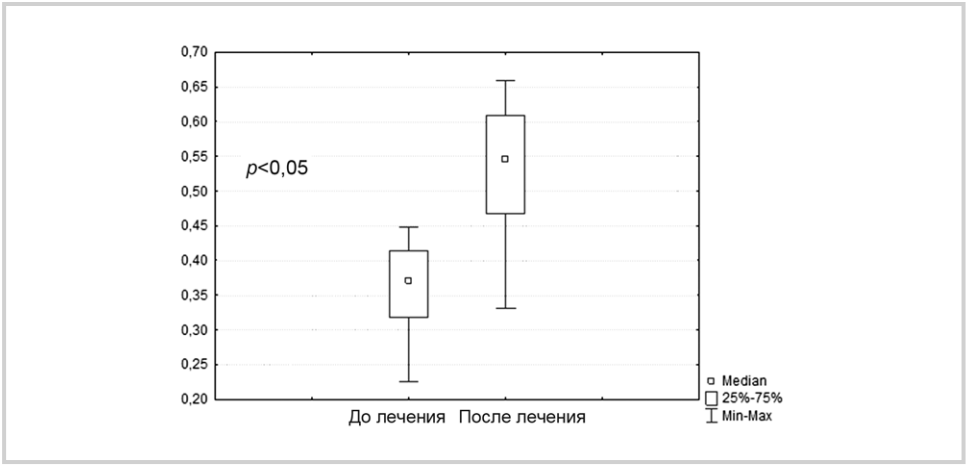
Рис. 3. Количество восстановленных SH-групп в плазме крови (m±M) при назначении 20 мг кортексина.
После назначения 10 мг кортексина существенно увеличилось число восстановленных SH-групп (рис. 2). Аналогичная динамика отмечена также и при назначении 20 мг кортексина (рис. 3). Динамика показателей восстановленных SH-групп при назначении 10 и 20 мг кортексина существенно не различалась (p>0,05).
Была отмечена хорошая переносимость препарата. За 6 мес из исследования выбыли 3 пациента 2-й группы в связи с нежелательными явлениями (общая слабость, головная боль) и 1 пациент — по не зависящим от лечения причинам.
Таким образом результаты настоящего исследования показали наличие дозозависимого действия кортексина при курсовом лечении ХИМ с применением 10 и 20 мг препарата. Установлено, что кортексин в дозировке 20 мг оказывает более выраженное действие на неврологические нарушения в целом, астенический синдром и диссомнию. Отмечен выраженный эффект кортексина 10 и 20 мг на когнитивные расстройства, не имеющий дозозависимого действия. Антидепрессивное и анксиолитическое действие кортексина проявляется только после назначения повторных курсов терапии. Кроме того, было подтверждено антиоксидантное действие препарата.
Здравоохранение в России 2017. Статистический сборник. М.: Росстат; 2017. [Healthcare in Russia 2017. Statistical collection. M.: Rosstat; 2017. (In Russ.)].
Сборник среднемосковских показателей деятельности медицинских организаций Департамента здравоохранения Москвы за 2013—2014 гг. М. 2015. [Collection of average Moscow indicators of medical organizations Moscow Health Department for 2013—2014 years. M. 2015. (In Russ.)].
Суслина З.А. Сосудистая патология головного мозга: итоги и перспективы. Анналы клинической и экспериментальной неврологии. 2007;1:10-16. [Suslina ZA. Vascular pathology of the brain: results and perspectives. Annals of Clinical and Experimental Neurology. 2007;1:10-16. (In Russ.)].
Болдырев А.А. Роль активных форм кислорода в жизнедеятельности. Успехи физиологических наук. 2003;34(3):21-34. [Boldirev AA. Role of active oxygen species in vital activity. Uspechi fiziologicheskich nauk. 2003; 34(3):21-34. (In Russ.)].
Верещагин Н.В., Пирадов М.А, Суслина З.А. Инсульт: принципы диагностики, лечения и профилактики. М.: Интермедика; 2002. [Vereshchagin NV, Piradov MA, Suslina ZA. Stroke: principles of diagnosis, treatment and prevention. M.: Intermedika; 2002. (In Russ.)].
Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина; 2001. [Gusev EI, Skvortsova VI. Brain Ischemia. M.: Medicine; 2001. (In Russ.)].
Федин А.И. Оксидантный стресс и применение антиоксидантов в неврологии. Атмосфера. Нервные болезни. 2002;1:15-18. [Fedin AI. Oxidant stress and the use of antioxidants in neurology. Atmosphere. Nervous diseases. 2002;1:15-18. (In Russ.)].
Clemens JA. Cerebral ischemia: gene activation, neuronal injury, and the protective role of antioxidants. Free Radical Biology and Medicine. 2000; 28(10):1526-1531.
Lounsbury KM, Hu Q, Ziegelstein RC. Calcium signaling and oxidant stress in the vasculature. Free Radic Biol Med. 2000;28:1362-1369.
Гомазков О.А. Нейротрофины: терапевтический потенциал и концепция минипептидов. Нейрохимия. 2012;3:1-11. [Gomazkov OA. Neurotrophins: therapeutic potential and the concept of minipeptides. Neurochemistry. 2012;3:1-11. (In Russ.)]. https://doi.org/10.1134/s1819712412030075
Головко А.И. Нейротрофические факторы головного мозга. Нейрохимия. 2008;25(4):261-271. [Golovko AI. Neurotrophic factors of the brain. Neurochemistry. 2008;25(4):261-271. (In Russ.)]. https://doi.org/10.1134/s1819712408040016
Гомазков О.А. Нейропептиды и ростовые факторы. М. 2002. [Gomazkov OA. Neuropeptides and growth factori. M. 2002. (In Russ.)].
Дьяконов М.М. К вопросу о нейропротекторном действии пептидных препаратов. Вестник Российской военно-медицинской академии. 2011; 3(33):255-258. [Dyakonov MM. To the question of the neuroprotective action of peptide preparations. Bulletin of the Russian Military Medical Academy. 2011;3(33):255-258. (In Russ.)].
Морозов В.Г., Хавинсон В.Х. Пептидные биорегуляторы (25-летний опыт экспериментального и клинического изучения). СПб.: Наука; 1996. [Morozov VG, Khavinson VKh. Peptide bioregulators (25 years of experience in experimental and clinical studies). SPb.: Nauka; 1996. (In Russ.)].
Яковлев А.А., Гуляева Н.В.. Молекулярные партнеры кортексина в мозге. Нейрохимия. 2016;33(4):1-6. [Yakovlev АА, Gulyaeva NV. Molecular partners of cortexin in the brain. Neurochemistry. 2016;33(4):1-6. (In Russ.)]. https://doi.org/10.7868/S1027813316040166
Демченко А.В., Беленичев И.Ф. Эффективность кортексина в условиях экспериментальной хронической ишемии мозга. Нейрохимия. 2016;33(1):76-81. [Demchenko AV, Belenichev IF. Efficacy of cortexin in experimental chronic cerebral ischemia. Neurochemistry. 2016;33(1):76-81. (In Russ.)]. https://doi.org/10.7868/S1027813316010052
Руденко А.О, Елтышева Т.Э., Дьяконов М.М. Влияние аминокислотного спектра пептидных органопрепаратов на эффективность фармакотерапии. Вестник Российской военно-медицинской академии. 2017; 1(57):129-136. [Rudenko AO, Eltysheva TE, D’yakonov MM. Effect of the amino acid spectrum of peptide organopreparations on the efficacy of pharmacotherapy. Bulletin of the Russian Military Medical Academy. 2017; 1(57):129-136. (In Russ.)].
Скоромец А.А., Дьяконов М.М. Кортексин. Пятилетний опыт оте-чественной неврологии. СПб.: Наука; 2005. [Skoromets AA, Dyakonov MM. Cortexin. Five-year experience of national neurology. SPb.: Nauka; 2005. (In Russ.)].
Ковальчук В.В., Миннуллин Т.И., Аманова Э.О., Галкин А.С., Эртман К.А. Нейропептиды в реабилитации пациентов после инсульта как фактор улучшения социально-бытовой адаптации, купирования болевых синдромов, нормализации когнитивных функций и качества жизни. Лечащий врач. 2016;10:74-81. [Kovalchuk VV, Minnulin TI, Amanova EY, Galkin AC, Ertman KA. Neuropeptides in the rehabilitation of patients after a stroke as a factor in improving social and domestic adaptation, relief of pain syndromes, normalization of cognitive functions and quality of life. Lecachiy vrach. 2016;10:74-81. (In Russ.)].
Машин В.В., Белова Л.А., Чапланова О.И. Открытое клиническое исследование препарата кортексин при дисциркуляторной энцефалопатии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(9):49-52. [Mashin VV, Belova LA, Chaplanova OI. Open clinical trial of cortexin in dyscirculatory encephalopathy. Zhurnal Nevrologii i Psihiatrii im. S.S. Korsakova. 2014;114(9):49-52. (In Russ.)].
Смолко Д.Г. Динамика когнитивных функций и биомаркеров ишемии при лечении кортексином пациентов с хронической сосудистомозговой патологией. Международный неврологический журнал. 2017; 87(1):2-6. [Smolko DG. Dynamics of cognitive functions and biomarkers of ischemia in the treatment of cortexin in patients with chronic cerebrovascular pathology. International Neurological Journal. 2017;87(1):2-6. (In Russ.)].
Федин А.И. Эффективность кортексина и мемантинола (мемантина) в лечении когнитивных нарушений у больных с хронической ишемией мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018; 118(1):30-36. [Fedin AI. Efficacy of cortexin and memantine (memantine) in the treatment of cognitive impairment in patients with chronic cerebral ischemia. Zhurnal Nevrologii i Psihiatrii im. S.S. Korsakova. 2018;118(1): 30-36. (In Russ.)].
Батышева Т.Т., Костенко Е.В., Зайцев К.А., Бойко А.Н. Нейропротекторы в комплексной терапии больных с хронической недостаточностью мозгового кровообращения в условиях кабинета клинической нейропсихологии ЦАО Москвы. Русский медицинский журнал. 2009; 17(9):784-788. [Batischeva TG, Kostenko EV, Zaycev KA, Boyoko AN. Neuroprotectors in complex therapy of patients with chronic cerebral circulatory insufficiency in the conditions of the clinical neuropsychology room of the Central Administrative District of Moscow. Russian Medical J. 2009; 17(9):784-788. (In Russ.)].