Подтвердите, пожалуйста, являетесь ли Вы дипломированным специалистом в сфере здравоохранения?
СОГЛАСНО ДЕЙСТВУЮЩЕМУ ЗАКОНОДАТЕЛЬСТВУ ИНФОРМАЦИЯ, ПРЕДОСТАВЛЕННАЯ В ДАННОМ РАЗДЕЛЕ, ПРЕДНАЗНАЧЕНА ИСКЛЮЧИТЕЛЬНО ДЛЯ ДИПЛОМИРОВАННЫХ СПЕЦИАЛИСТОВ В СФЕРЕ МЕДИЦИНЫ И ФАРМАЦЕВТИКИ
В.В. Ковальчук, доктор медицинских наук, профессор
Т. И. Миннуллин, кандидат медицинских наук
Э. О. Аманова
А. С. Галкин, кандидат медицинских наук
ГБУЗ ГБ № 38 им. Н. А. Семашко, Санкт-Петербург
Резюме. Рассмотрены подходы к реабилитации пациентов после инсульта, восстановлению функций организма и когнитивных функций больного с помощью физических и психологических методов, а также с помощью медикаментозной терапии.
Ключевые слова: инсульт, реабилитация, когнитивные функции, деменция, боль, качество жизни, нейропептиды.
Инсульты продолжают оставаться одной из важнейших проблем современного общества, являясь основной причиной глубокой и длительной инвалидизации населения.
Целью реабилитации является возвращение пациента к активной социально-бытовой деятельности, создание оптимальных условий для его активного участия в жизни общества и в конечном итоге улучшение качества жизни как самого больного, так и его родственников.
Основными задачами реабилитации являются восстановление жизненно важных функций человека с помощью физических и психологических методов, воздействие на организм больного с помощью медикаментозной терапии для улучшения и нормализации обменных процессов, а также выработка системы адаптации при необратимых изменениях, вызванных патологическим процессом.
Одним из основных механизмов, обеспечивающих восстановление функций пациентов, является нейропластичность, которая заключается в способности нервной ткани менять как структурную, так и функциональную организацию под влиянием внешних и внутренних факторов.
Нейрональная реорганизация и соответственно пластичность нервной системы связаны со следующими механизмами: функционирование ранее неактивных связей, спруттинг волокон сохранившихся нейронов (возобновление роста пораженного аксона, изменение ветвистости волокон, площади и плотности шипиков дендритов), формирование новых синапсов, синаптическое ремоделирование (изменение конфигурации и свойств синапсов), реорганизация нейрональных цепей (формирование многих цепей, обеспечивающих близкие функции), обеспечение внесинаптической нейрональной передачи возбуждения, изменения астроглии (изменение структуры астроцитов, увеличение числа контактов синапсов и астроцитов).
Восстановление двигательных, чувствительных, когнитивных функций, уровень социально-бытовой адаптации, купирование болевых синдромов у пациентов после инсульта, а также качество их жизни в существенной степени зависят от своевременного и адекватного применения методов физической и нейропсихологической реабилитации, осуществления правильного ухода, соблюдения мультидисциплинарного принципа ведения данной категории пациентов, однако согласно результатам различных исследований использование медикаментозной терапии в рамках комплексной реабилитации также имеет существенное значение относительно повышения ее эффективности.
В последнее время при проведении реабилитации неврологических пациентов широко рассматривается вопрос активного применения нейропептидов. Нейропептиды — биологически активные вещества, которые принимают участие в регуляции метаболизма и поддержании системы саморегуляции организма. Данные вещества регулируют практически все функции центральной нервной системы, а также принимают участие в управлении вегетативными реакциями и контролировании болевой чувствительности.
Нейропептиды осуществляют контроль за экспрессией вторичных клеточных мессенджеров, цитокинов и других сигнальных молекул, а также за запуском генетических программ антиапоптозной защиты и активизации нейротрофического метаболизма, в то же время, обладая самостоятельным нейротрофическим эффектом, способствуя, таким образом, активации нейрорепаративных и нейрорегенераторных механизмов. Перечисленные выше эффекты нейропептидов приводят к стимуляции процессов нейропластичности, что крайне важно при проведении реабилитации пациентов после инсульта.
Для изучения влияния терапии с использованием нейропептидов на эффективность реабилитации пациентов после инсульта было проведено исследование, цель которого состоит в повышении эффективности реабилитации данной категории пациентов, а задачей является изучение влияния препарата Кортексин на восстановление неврологических функций пациентов после инсульта, уровень их социально-бытовой адаптации, а также качество жизни.
Одна из задач исследования состоит также в анализе эффективности применения Кортексина при терапии состояний, являющихся одними из основных сдерживающих факторов на пути адекватного восстановления пациентов, к которым наряду с другими, можно отнести болевые синдромы и когнитивные расстройства.
Кортексин представляет собой препарат пептидной структуры, механизм действия которого связан с его метаболической активностью, что, в свою очередь, заключается в регулировании уровня концентрации тормозных и возбуждающих аминокислот, серотонина и дофамина. Кроме того, Кортексин обладает антиоксидантной активностью и способностью восстанавливать биоэлектрическую активность головного мозга, а также уменьшает нейротоксичность глутамата, в связи с чем обладает нейроцитопротекторным действием на фоне окислительного стресса. Важным компонентом механизма действия данного препарата является его способность препятствовать развитию апоптоза.
Анализу были подвергнуты результаты лечения 1240 пациентов, перенесших ишемический инсульт. Демографические характеристики пациентов — средний возраст 646 женщин и 594 мужчин составил 69,7 года (от 33 до 89 лет).
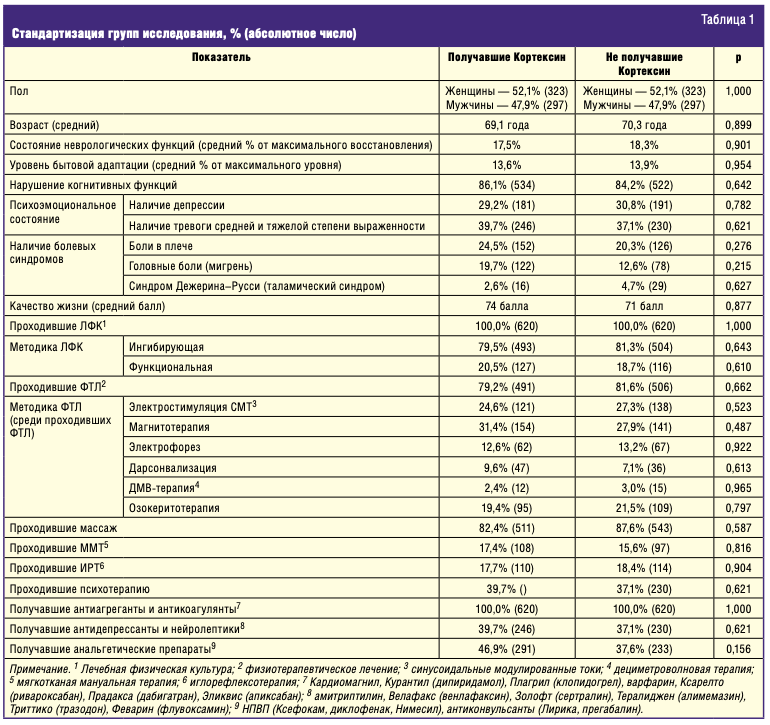
Все пациенты были разделены на две группы по 620 человек (получавшие и не получавшие Кортексин), которые были стандартизированы по различным показателям, таким как возраст, пол, степень выраженности неврологических и психоэмоциональных нарушений, уровень бытовой адаптации, качество жизни, а также проводимые виды и методы физической, физиотерапевтической, нейропсихологической и психотерапевтической реабилитации (принцип matchedcontrolled).
Стандартизация исследуемых групп, проведенная по перечисленным показателям сопоставимости, представлена в табл. 1. Чем выше значение р, тем более близки группы лечения по тому или иному показателю. В случае р = 1,000 наблюдается полное совпадение между группами по определенному показателю.
Настоящее исследование проводилось в Центре медицинской реабилитации на базе ГБУЗ ГБ № 38 им. Н.А.Семашко (Санкт-Петербург) в период с 2013 г. по 2016 г.
Дизайн исследования имеет проспективный сравнительный открытый характер.
Кортексин назначался на 1–2 и 6–7 месяцах инсульта и применялся повторными курсами с интервалом между ними в 10 дней.
Применялась следующая схема использования и дозировка препарата: ежедневно внутримышечно в дозе 10 мг 2 раза в сутки в течение 10 дней.
Анализ результатов лечения производился по следующим параметрам: восстановление неврологических функций, уровень социально-бытовой адаптации, нормализация когнитивных функций, купирование/уменьшение выраженности болевых синдромов и качество жизни пациентов.
Нарушение и степень восстановления неврологических функций определялись при помощи шкал Бартел, Линдмарка и Скандинавской шкалы. По шкале Бартел оценивались двигательные функции и бытовая адаптация; по шкале Линдмарка — функции движения и чувствительности; по Скандинавской — двигательные, речевые функции, ориентация во времени, пространстве и собственной личности. Соответственно полученным результатам степень восстановления определялась следующим образом: отсутствие восстановления — среднее арифметическое количество баллов, набранное по всем трем перечисленным шкалам, составляло менее 30% баллов от их максимального количества; минимальное — 30–49%; удовлетворительное — 50–74%; достаточное — 75–94%; полное — более 94%.
Уровень бытовой и социальной адаптации определялся по шкале самооценки бытовых возможностей повседневной жизни Мертон и Саттон. Соответственно полученным результатам степень бытовой адаптации определялась следующим образом: отсутствие бытовой адаптации — 0 баллов; минимальная — 1–29 баллов; удовлетворительная — 30–45 баллов; достаточная — 46–58 баллов; полная — 59 баллов.
Когнитивные функции оценивались с помощью краткой шкалы оценки ментального статуса — MMSE (Mini-Mental State Examination) и Монреальской шкалы оценки когнитивных функций (МоСА).
Соответственно полу ченным результатам по шкале MMSE состояние когнитивных функций определялось следующим образом: 28–30 баллов — нет нарушений когнитивных функций, 24–27 баллов — преддементные (легкие) когнитивные расстройства, 20–23 балла — деменция легкой степени выраженности, 11–19 баллов — деменция умеренной степени выраженности, 0–10 баллов — деменция тяжелой степени выраженности; степень улучшения когнитивных функций определялась следующим образом: незначительное улучшение — увеличение количества баллов на 1–6 баллов; удовлетворительное — на 7–13 баллов; выраженное улучшение — на 14 и более баллов.
Согласно результатам, полученным по шкале МоСА, наличие когнитивных расстройств признавалось при выявлении 25 и менее баллов; степень улучшения когнитивных функций согласно шкале МоСА определялась следующим образом: незначительное улучшение — увеличение количества баллов на 1–5 баллов; удовлетворительное — на 6–11 баллов; выраженное улучшение — на 12 и более баллов.
Анализ эффективности нейропептидной терапии в отношении купирования болевых синдромов производился следующим образом. Поскольку оценка выраженности болевого синдрома носит достаточно субъективный характер, для объективизации результатов исследования были использованы две шкалы оценки боли: визуальная аналоговая шкала (ВАШ) Хаскиссона и многомерный вербально-цветовой тест боли (МВЦТБ), в рамках применения которого в качестве диагностического средства используются как вербальные, так и невербальные символы, прежде всего цвет. Кроме того, использование данного теста позволяет проводить дифференциальную диагностику психогенного болевого синдрома, который нередко встречается среди рассматриваемой категории пациентов и может несколько искажать объективные результаты исследования относительно оценки выраженности болевого синдрома. Степень выраженности болевых ощущений, согласно выбору пациентом предпочтительных цветов, подразделялась на 7 рангов: отсутствие боли; очень слабая мимолетная боль; слабая боль; боль средней степени выраженности; сильная боль; очень сильная боль; невыносимая боль («сильнее быть не может»).
Анализ выраженности болевого синдрома с помощью ВАШ производился следующим образом. Интенсивность болевого синдрома измерялась во всех случаях одной и той же линейкой слева направо с точностью до 1 мм (0 мм соответствует отсутствию боли, 100 мм — максимальной когда-либо испытываемой пациентом боли). Соответственно полученным результатам оценивали выраженность болевого синдрома: отсутствие боли — 0,0–10,0 мм, минимальная боль — 10,1–30,0 мм, умеренная боль — 30,1–50,0 мм, сильная боль — 50,1–70,0 мм, очень сильная боль — 70,1–90,0 мм, максимальная боль — 90,1–100 мм.
Качество жизни пациентов определялось с помощью профиля влияния болезни (Sickness Impact Profile). Соответственно количеству баллов, набранных по данной шкале, качество жизни оценивалось следующим образом: отсутствие нарушений качества жизни — 0 баллов; минимальные нарушения — 1–10 баллов; легкие нарушения — 11–25 баллов; умеренные нарушения — 26–40 баллов; выраженные нарушения — 41–55 баллов; грубые нарушения — более 55 баллов.
Критерии включения пациентов в настоящее исследование:
На основе полученных данных была создана компьютерная база данных с возможностью статистического анализа. Все клинические показатели, зарегистрированные при обследовании пациентов, были адаптированы для математической обработки и изучались с использованием методов многомерного статистического анализа.
Для проверки близости к нормальному распределению наблюдавшихся значений факторов и параметров (т. е. сопоставления теоретически и экспериментально полученных распределений) были использованы критерий Пирсона χ2 и критерий Колмогорова – Смирнова. В исследовании были использованы пакеты следующих прикладных программ: Statistica for Windows 8.0 (для статистического анализа), MS Office 2010 (для организации и формирования матрицы данных, подготовки графиков и диаграмм). Оценка достоверности различий средних величин для независимых переменных осуществлялась по t-критерию Стьюдента. Различия считались достоверными при p < 0,05. При частоте изучаемого события менее 5 наблюдений в одной из ячеек таблицы, использование критерия χ2 признавалось не корректным и требовало использования точного критерия Фишера.

Согласно результатам исследования, использование Кортексина при реабилитации пациентов после инсульта в статистически достоверной степени повышает ее эффективность. Так, в группе пациентов, в рамках терапии которых использовался Кортексин, достаточная и полная степень восстановления неврологических функций отмечалась у 62,1% больных, в группе больных, не получавших данный препарат, — у 45,3% (р < 0,01) (табл. 2).
Кроме того, применение Кортексина вызывает достоверное повышение уровня бытовой адаптации пациентов после инсульта. Так, в группе пациентов, получавших данный препарат, достаточная и полная степень бытовой адаптации отмечалась в 60,6% случаев, а в группе больных, не получавших Кортексин,— в 43,9% случаев (р < 0,01) (табл. 2).
Кроме того, как показали результаты исследования, применение Кортексина в статистически достоверной степени влияет на нормализацию когнитивных функций пациентов после инсульта. Говоря об улучшении когнитивных функций, необходимо отметить, что данное заключение было сделано на основании анализа результатов лечения как по шкале MMSE, так и по шкале МоСА.
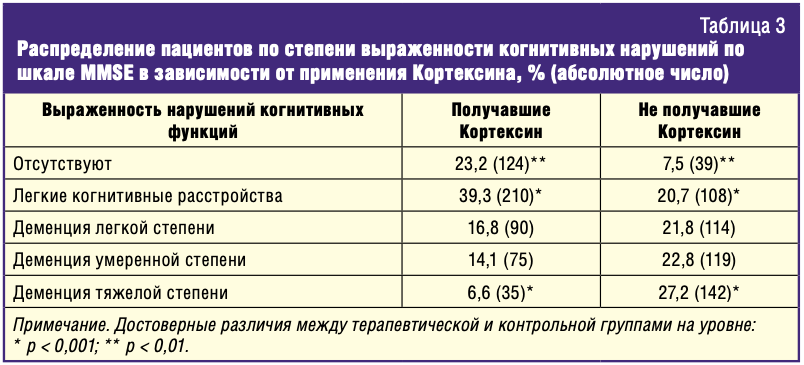
Среди пациентов с нарушениями когнитивных функций, при реабилитации которых использовался Кортексин, согласно проведенному исследованию по шкале MMSE, когнитивные расстройства легкой степени и отсутствие оных после проведенных курсов терапии наблюдались у 62,5% больных, а среди не получавших данный препарат — у 28,2% (р < 0,001) (табл. 3). В то же время деменция тяжелой степени наблюдалась у 6,6% пациентов первой группы и у 27,2% — второй группы (р < 0,01).
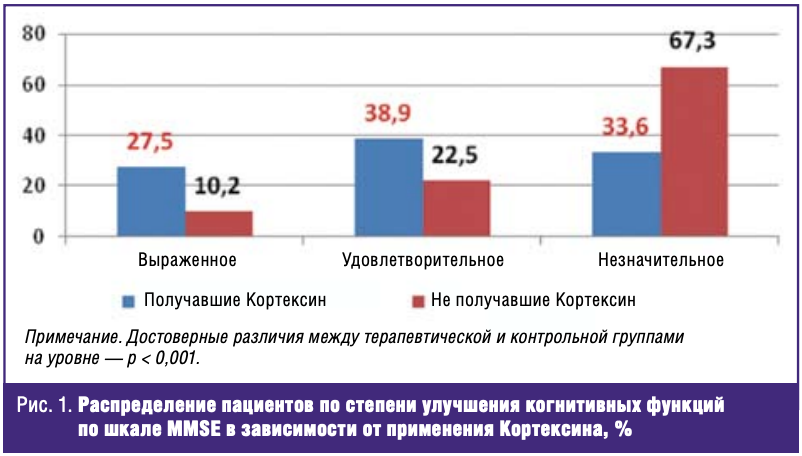
Также согласно результатам проведенного исследования, наблюдаются статистически значимые различия между группами пациентов, в рамках реабилитационного лечения которых использовался и не использовался Кортексин, относительно динамики состояния когнитивных функций (рис. 1).
Так, в группе больных, получавших Кортексин, удовлетворительная и выраженная степень улучшения когнитивных функций наблюдалась у 66,4%, в группе не получавших данный препарат аналогичный показатель составляет 32,7% (р < 0,001). В то же время, незначительная степень улучшения когнитивных функций в группе Кортексина составляет 33,6%, в контрольной группе — 67,3% (р < 0,001) (рис. 1).
Согласно результатам оценки эффективности терапии по шкале МоСА, в группе пациентов, при реабилитации которых использовался Кортексин, когнитивные расстройства различной степени выраженности наблюдались у 68,1%, в группе не получавших Кортексин — у 87,8% (р < 0,01).
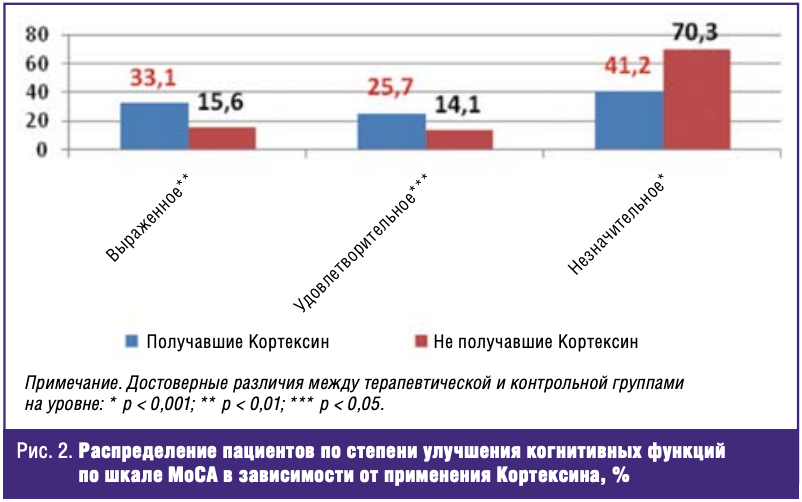
Также наблюдаются статистически значимые различия между группами исследования в плане динамики состояния когнитивных функций, проанализированной согласно шкале МоСА (рис. 2).
Так, в группе пациентов, в рамках терапии которых применялся Кортексин, удовлетворительная и выраженная степень улучшения когнитивных функций наблюдалась у 58,8% больных, в группе больных, не получавших данный препарат, — у 29,7% (р < 0,001), в то время как незначительная степень улучшения когнитивных функций в группе Кортексина составляет 41,2%, в контрольной группе — 70,3% (р < 0,001) (рис. 2).
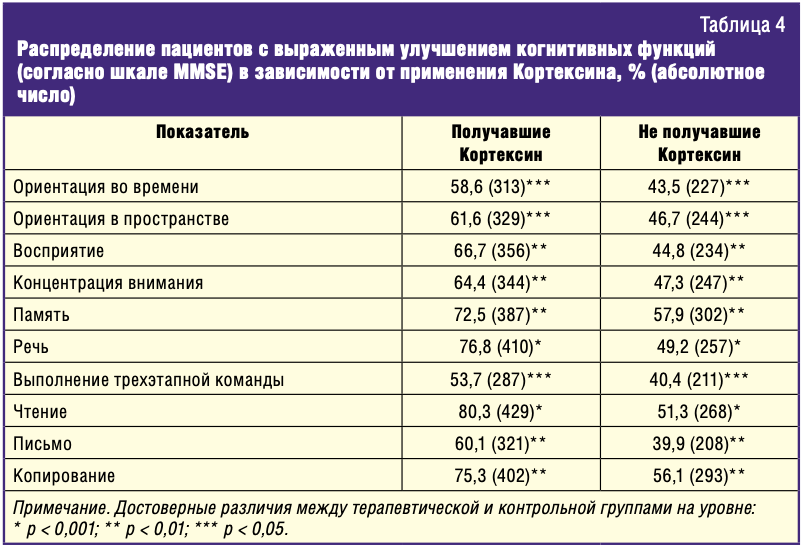
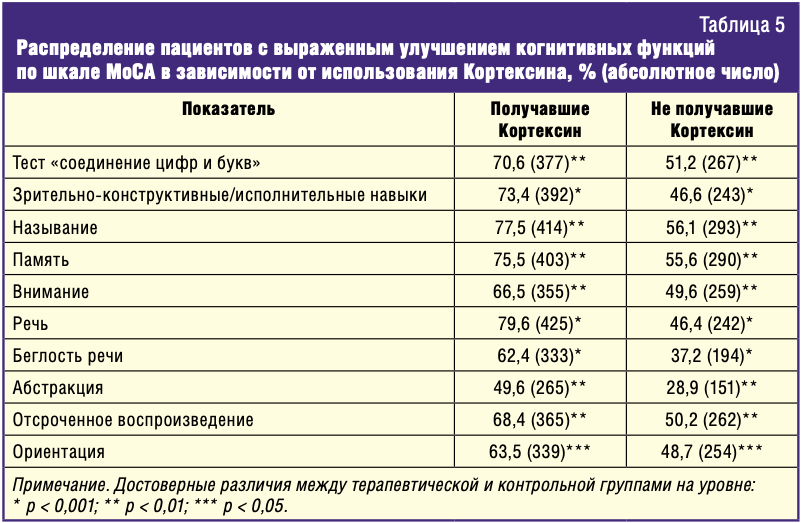
Применение Кортексина в статистически достоверной степени способствует нормализации всех исследуемых когнитивных функций (табл. 4, 5). Наибольшее влияние применение данного препарата оказало на нормализацию и улучшение речи, ее беглости, чтения и реализации зрительно-конструктивных/исполнительных навыков, что, безусловно, в значительной степени способствует повышению уровня социально-бытовой адаптации.
Согласно результатам исследования, проведенным по шкале MMSE, в группе имеющих когнитивные нарушения пациентов, получавших Кортексин, выраженное улучшение речи наблюдалось на фоне терапии у 76,8%, чтения — у 80,3%. Аналогичные показатели среди пациентов, не получавших Кортексин, составляют соответственно 49,2% (р < 0,001) и 51,3% (р < 0,001) (табл. 4).
Согласно результатам исследования, проведенного по шкале МоСА, в группе пациентов, в терапии которых использовался Кортексин, выраженное улучшение речи наблюдалось у 79,6%, выполнения зрительноконструктивных навыков — у 73,4%, беглости речи — у 62,4%. Аналогичные показатели среди пациентов контрольной группы составляют соответственно 46,4% (р < 0,001), 46,6% (р < 0,001) и 37,2% (р < 0,001) (табл. 5).
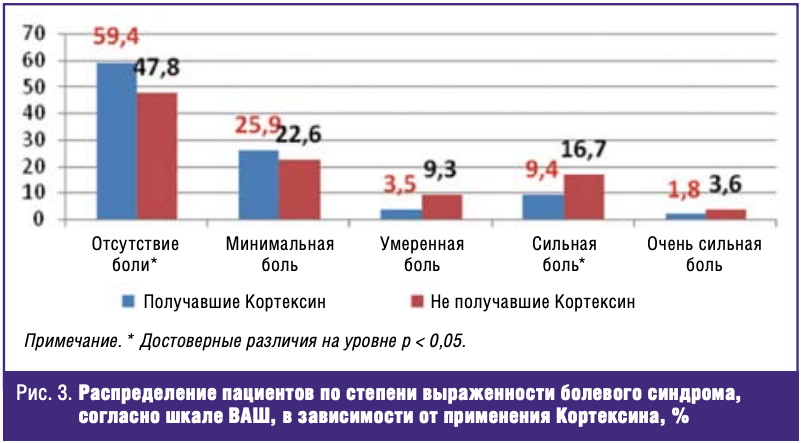
Как показали результаты исследования, реабилитация с использованием нейропептидной терапии в существенной степени влияет и на купирование и уменьшение выраженности болевых синдромов у пациентов после инсульта, что, безусловно, расширяет возможности использования различных методов и видов реабилитации и, соответственно, способствует повышению эффективности реабилитации. Как мы видим, наблюдаются статистически значимые различия в отношении купирования и уменьшения выраженности болевого синдрома в группах, получавших и не получавших Кортексин.
Так, отсутствие и минимальная выраженность болевого синдрома, согласно шкале Хаскиссона (ВАШ), среди пациентов, страдающих теми или иными болевыми синдромами, на фоне терапии с применением Кортексина отмечались у 85,3% пациентов, в контрольной группе — у 70,4% (р < 0,05) (рис. 3).
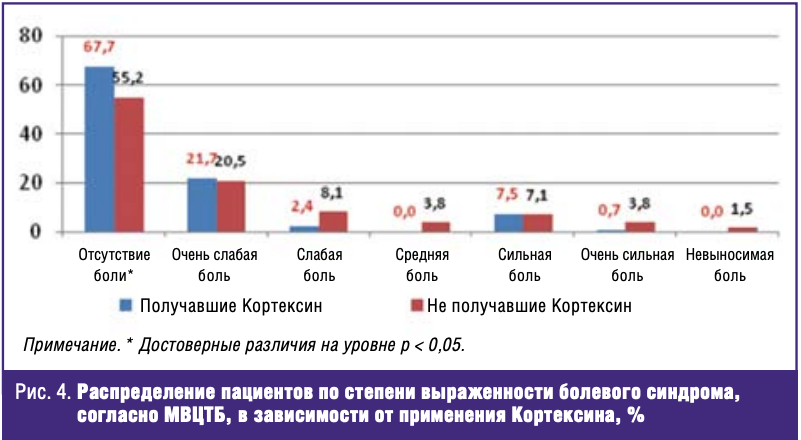
Соответственно оценке эффективности терапии с помощью многомерного вербально-цветового теста боли, купирование болевого синдрома или очень слабая боль в группе Кортексина отмечались в 89,4% случаев. Аналогичный показатель в группе, не получавших Кортексин, составил 75,7% (р < 0,05) (рис. 4).
Данное заключение, на первый взгляд, может показаться достаточно неожиданным, однако оно может быть объяснено тем, что нейропептиды принимают достаточно активное участие в контролировании болевой чувствительности.
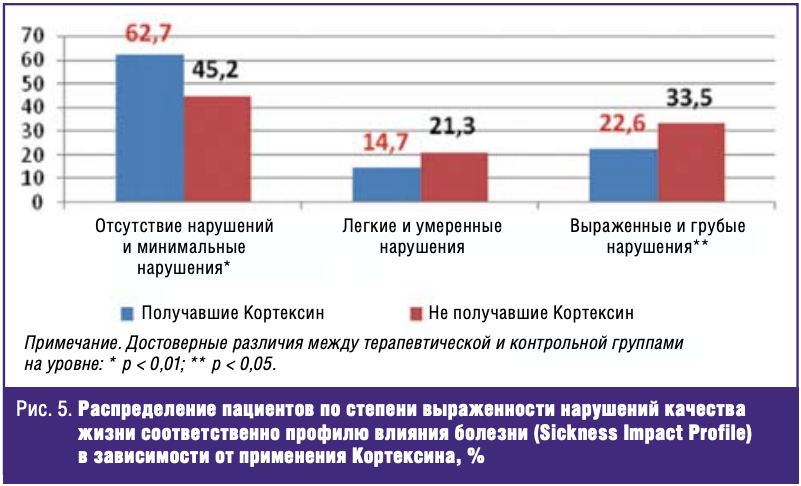
Согласно результатам исследования, уровень качества жизни соответственно профилю влияния болезни (Sickness Impact Profile) у пациентов, получавших Кортексин, в статистически достоверной степени выше, нежели у больных, не получавших данный препарат.
Так, в группе пациентов, получавших Кортексин, отсутствие нарушений качества жизни и их минимальная выраженность наблюдались у 62,7%, в контрольной группе — у 45,2% (р < 0,01) (рис. 5). Напротив, выраженные и грубые нарушения качества жизни отмечались у 22,6% пациентов в группе Кортексина и у 33,5% — в контрольной группе (р < 0,05) (рис. 5).
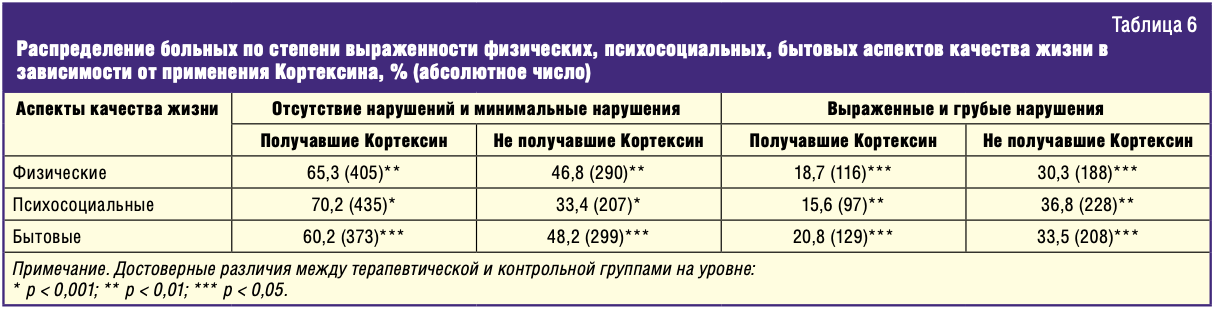
Как свидетельствуют результаты исследования, Кортексин статистически достоверно улучшал и физические, и психосоциальные, и бытовые составляющие качества жизни.
Так, в группе пациентов, получавших Кортексин, отсутствие нарушений физических характеристик качества жизни (уход за телом, перемещение, функциональная мобильность) и их минимальная выраженность наблюдались у 65,3% больных, в контрольной группе — у 46,8% (р < 0,01). Выраженные и грубые нарушения данных составляющих качества жизни отмечали 18,7% пациентов группы Кортексина и 30,3% — контрольной группы (р < 0,05) (табл. 6).
Отсутствие нарушений психосоциальных аспектов качества жизни (эмоциональность, социальное взаимодействие, инициативность, энергичность поведения, общение) и их минимальная выраженность отмечались у 70,2% пациентов, получавших Кортексин, и у 33,4% больных, не получавших данный препарат (р < 0,001). Выраженные и грубые нарушения данных составляющих качества жизни наблюдалось в 15,6% случаев в группе Кортексина и в 36,8% — в контрольной группе (р < 0,01) (табл. 6).
В группе пациентов, получавших Кортексин, отсутствие нарушений бытовых характеристик качества жизни (работа, сон, отдых, досуг, питание, ведение домашнего хозяйства) и их минимальная выраженность наблюдались у 60,2% больных, в контрольной группе — у 48,2% (р < 0,05). Выраженные и грубые нарушения данных составляющих качества жизни отмечали 20,8% пациентов в группе Кортексина и 33,5% — в контрольной группе (р < 0,05) (табл. 6).
Как показали результаты исследования, применение Кортексина при реабилитации пациентов после инсульта в статистически достоверной степени повышает эффективность проводимого лечения, что проявляется и в отношении повышения степени восстановления двигательных, чувствительных, когнитивных функций пациентов, и в отношении возрастания уровня их социальнобытовой адаптации и качества жизни.
Результаты настоящего исследования позволяют сделать следующие выводы.
Полученные результаты согласуются с данными других авторов о положительном влиянии Кортексина на повышение эффективности реабилитации пациентов, перенесших инсульт.
Таким образом, результаты исследования свидетельствуют об оправданности и целесообразности применения препарата Кортексин при проведении реабилитации пациентов, перенесших инсульт, с целью повышения ее эффективности, что, безусловно, позволяет рекомендовать данный препарат для широкого использования в клинической практике.
Учитывая большое разнообразие лекарственных препаратов, предлагаемых для реабилитации пациентов, перенесших инсульт, и отсутствие единодушного мнения исследователей в отношении их эффективности, можно отметить, что дальнейшие исследования в данной области представляются достаточно интересными и чрезвычайно полезными.
Дамулин И.В., Кононенко Е.В. Двигательные нарушения после инсульта: патогенетические и терапевтические аспекты // Consilium medicum. 2007. № 2. С. 86–91.
Hallet M. Plasticity of human motor cortex and recovery from stroke // Brain Res Rev. 2001. Vol. 36. P. 169–174.
Камаева О.В., Монро П. Мультидисциплинарный подход в ведении и ранней реабилитации неврологических больных. Методическое пособие / Под ред. А.А.Скоромца. СПб, 2003.
Ковальчук В.В., Скоромец А. А. Основные принципы и результаты деятельности мультидисциплинарной бригады при восстановительном лечении пациентов, перенесших инсульт, на примере опыта работы центра неврологической реабилитации // Неврологический вестник им. В.М.Бехтерева. 2007. № 4. С. 5–9.
Виленский Б.С. Инсульт. СПб: Медицинское информационное агентство, 1995.
Ковальчук В.В. Терапевтические возможности улучшения когнитивных функций, психоэмоционального состояния и качества жизни пациентов после инсульта // Журнал неврологии и психиатрии им. С.С.Корсакова. 2015. № 12. С. 92–97.
De Wied D. The neuropeptide concept // Progr in Brain Res. 1987. Vol. 72. P. 93–108.
Ашмарин И.П., Стукалов П.В. Нейрохимия. М.: Изд-во Инст. биомед. химии РАМН, 1996.
Hershkovitz M., Zwiers H., Gispen W.H. The effect of ACTH on rat brain synaptic plasma lipid fluidity // Biochim Acta. 1982. Vol. 692. P. 495–497.
Скворцова В.И., Евзельман М.А. Ишемический инсульт. Орел, 2006. 404 с.
Скоромец А.А., Дамбинова С.А., Дьяконов М.М. и др. Новый биохимический маркер церебральной ишемии // Клиническая медицина Казахстана. 2009. № 1. C. 198–199.
Гранстрем О.К., Сорокина Е.Г., Сторожевых Т.П. и др. Последние новости о Кортексине (нейропротекция на молекулярном уровне) // Terra Medica Nova. 2008. № 5. C. 1–4.
Семке В.Я., Иванова С.А., Большова А. Нейропротекторы в борьбе с апоптозом и их применение на ранних этапах терапии // Медицинский вестник. 2008. № 6–7. C. 15.
Machoney F., Barthel D. Functional evalution: the Barthel Index // Md State Med J. 1965. Vol. 14. P. 61–65.
Lindmark B. Evaluation of functional capacity after stroke with special emphasis on motor function and activities of daily living // Scand J Rehabil Med Suppl. 1988. Vol. 21. P. 1–40.
Scandinavian Stroke Study Group. Multicenter trial of hemodilution in ischemic stroke: background and study protocol // Stroke. 1985. Vol. 16. P. 885–890.
Kwantabisa N. Occupational therapy ADL checklist self maintenance // Merton and Sutton Community NHS Trust. Stroke Rehabilitation Team Protocol. London, 1999. P. 7–9.
Folstein M.F., Folstein, S. E., Hugh P.R. «Mini-Mental State». A practical method for grading the cognitive state of patients for the clinician // Journal of Psychiatric Research. 1975. Vol. 12. P. 189–198.
Nasreddine Z.S., Phillips N.A., Bedirian V. et al. The Montreal cognitive assessment, MoCA: a brief screening tool for mild cognitive impairment // J Am Geriatr Soc. 2005. Vol. 53. P. 695–699.
Scott J., Huskisson E.C. Graphic representation of pain // Pain. 1976. Vol. 2. P. 175–184.
Адашинская Г.А., Мейзеров Е.Е., Фадеев А.А. и др. Экспертная система оценки боли, созданная на основе «Многомерного вербально-цветового болевого теста» / Материалы конгресса «Традиционная медицина 2007». М., 2007. С. 502–507.
Ковальчук В.В. Оценка эффективности и безопасности Мидокалма в раннем восстановительном периоде инсульта // Журнал неврологии и психиатрии им. С.С.Корсакова. 2013. № 4. С. 35–40.
Bergner M., Bobbitt R.A., Carter W.B. et al. The Sickness Impact Profile: development and final revision of a health status measure // Med. Care. 1981. Vol. 19. P. 787–805.
Ковальчук В.В., Лалаян Т.В., Смолко Д.Г. Функциональное состояние пациентов после инсульта: возможности современных подходов к терапии // Эффективная фармакотерапия. Неврология и психиатрия. 2013. № 2. С. 8–12.
Новикова Л.Б., Валитова Г.Г. Особенности лечения пациентов с ишемическим инсультом на фоне артериальной гипертонии // Участковый терапевт. 2008. № 4. C. 5.
Нургужаев Е.С., Митрохин Д.А., Избасарова А.Ш. и др. Применение кортексина у больных в раннем восстановительном периоде ишемического инсульта средней тяжести // Журнал неврологии и психиатрии им. С.С.Корсакова. 2009. № 7. C. 66–69.